��Ŀ����
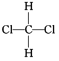
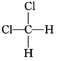
����Ŀ��A��B��D��E��G��ԭ������������������ֶ�����Ԫ�أ�A��Eͬ���壬A��B��E��ԭ������������֮��Ϊ19��B��G�ĵ��ʶ�����H2��Ӧ������HX��(X����B��G)���⻯��,DΪͬ��������Ԫ����ԭ�Ӱ뾶����Ԫ�ء�
(1)B��Ԫ�����ڱ��е�λ����______��
(2)D�����ֳ����������о�����____________(�������Ӽ����������ۼ���)��
(3)E������������Ӧˮ�����Ũ��Һ��ľ̿����,��Ӧ�Ļ�ѧ����ʽΪ____________��
(4)D������������Ӧˮ�������Һ��G�ĵ��ʷ�Ӧ,��Ӧ�����ӷ���ʽΪ___________��
(5)��ԭ�ӽṹ������B��G���ʶ�����H2��Ӧ����HX���⻯������ԭ��________��
���𰸡���2���ڵ�VIIA�� ���Ӽ� 2H2SO4(Ũ)+C ![]() CO2��+2SO2��+2H2O Cl2+2OH���TClO��+Cl��+H2O ������ͬ��VIIA��,��ԭ��������������Ϊ7,��������ԭ�ӹ���һ�Ե����γɹ��ۼ�
CO2��+2SO2��+2H2O Cl2+2OH���TClO��+Cl��+H2O ������ͬ��VIIA��,��ԭ��������������Ϊ7,��������ԭ�ӹ���һ�Ե����γɹ��ۼ�
��������
A��B��D��E��G ��ԭ������������������ֶ�����Ԫ�أ�����B��Gͬ���壬B ��G �ĵ��ʶ�����H2��Ӧ������HX��(X����B��G)���⻯���BΪFԪ�أ�GΪClԪ�أ�DΪͬ��������Ԫ����ԭ�Ӱ뾶����Ԫ�أ�ԭ����������F��С��Cl����DΪNaԪ�أ�A��Eͬ���壬A��B��E��ԭ������������֮��Ϊ19����֪A��E��������������Ϊ6����AΪOԪ�أ�EΪSԪ�أ���϶�Ӧ���ʡ�������������Լ�Ԫ��������֪ʶ�Ľ��
A��B��D��E��G ��ԭ������������������ֶ�����Ԫ�أ�����B��Gͬ���壬B ��G �ĵ��ʶ�����H2��Ӧ������HX��(X����B��G)���⻯���BΪFԪ�أ�GΪClԪ�أ�DΪͬ��������Ԫ����ԭ�Ӱ뾶����Ԫ�أ�ԭ����������F��С��Cl����DΪNaԪ�أ�A��Eͬ���壬A��B��E��ԭ������������֮��Ϊ19����֪A��E��������������Ϊ6����AΪOԪ�أ�EΪSԪ�أ�
(1)BΪFԪ�أ�λ�����ڱ���2���ڵ�VIIA�壻
(2)DΪNaԪ�أ������ֳ���������Ϊ�����ơ��������ƣ����߾��������Ӽ���
(3)E������������Ӧˮ�����Ũ��ҺΪŨ���ᣬ����ǿ�����ԣ���ľ̿���ȷ�Ӧ��ѧ����ʽΪ2H2SO4(Ũ)+C![]() CO2��+2SO2��+2H2O��
CO2��+2SO2��+2H2O��
(4)�������������Ʒ�Ӧ�����Ȼ��ƺʹ������ƣ���Ӧ�����ӷ���ʽΪCl2+2OH-�TClO-+Cl-+H2O��
(5)������ͬ��VIIA�壬��ԭ��������������Ϊ7����������ԭ�ӹ���һ�Ե����γɹ��ۼ������ʶ�����H2 ��Ӧ����HX ���⻯�

����Ŀ������ʵ�����������ͽ��۾���ȷ����
ѡ�� | ʵ����� | ���� | ���� |
A | �����pH=2��HX��HY������ֱ�������������Ӧ������ˮ���ռ����� | HX�ų����������Ҳ�������H2��Ӧ���ʿ� | ���ǿ����HX��HY |
B | ��2 mL 0.1 mol/L Na2S��Һ�е�2��0.1 mol/L ZnSO4��Һ���ٵ�2��0.1 mol/L CuSO4 | �����ɰ�ɫ�����������ɺ�ɫ���� | �ܶȻ�(Ksp)��ZnS>CuS |
C | ��FeCl3��KSCN�����Һ�У���������KCl�Ĺ��� | ��Һ��ɫ��dz | FeCl3+3KSCN |
D | �����£���pH�Ʒֱ�ⶨ����NaA��Һ�ͱ���NaB��Һ��pH | pH��NaA��NaB | ���������ԣ�HA��HB |
A. A B. B C. C D. D