题目内容
(1)实验室用二氧化锰跟浓硫酸共热反应,二氧化锰被还原成Mn2+并制取氯气的化学方程式是___________________________________。
(2)高锰酸钾是常用的氧化剂。在酸性条件下,MnO4-被还原成Mn2+。用高锰酸钾跟浓盐酸在室温下制氯气的反应的离子方程式是___________________________。
(3)历史上曾用“地康法”制氯气。该方法是用氯化铜作催化剂,在450℃利用空气中的氧气跟氯气反应制氯气,反应的化学方程式为________________________________。
(4)从氯元素化合价的变化看,以上三种方法的共同点是______________________。
(5)比较以上三个反应,可认为氧化剂的氧化能力从强到弱的顺序为________________。
(1)MnO2+2H2SO4(浓)+2NaClMnSO4+Cl2↑+Na2SO4+2H2O。
(2)2MnO4-+10Cl-+16H+=2Mn2++8H2O+Cl2↑。
(3)4HCl+O2![]() 2Cl2↑+2H2O。
2Cl2↑+2H2O。
(4)都是利用氧化剂把负一价的氯元素氧化成0价态的氯气。
(5)从反应条件看,高锰酸钾最容易把氯化氢氧化成氯气,氧气最难把氯化氢氧化成氯气。所以,这三种氧化剂的氧化能力从强到弱的顺序为:高锰酸钾、二氧化锰、氧气。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
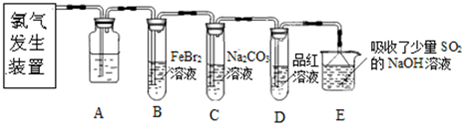
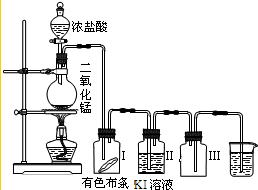 某同学实验室用下列装置探究氯气的性质.
某同学实验室用下列装置探究氯气的性质.