题目内容
(1)实验室用二氧化锰跟浓盐酸反应制取氯气的离子方程式为(2)高锰酸钾是常用氧化剂,在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气的离子方程式为
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为
(4)现有100mL AlCl3与MgSO4的混合溶液,分成两等份.
①向其中一份中加入10mL 4mol/L的氨水,恰好完全反应,其中AlCl3与氨水反应的离子方程式是
②向另一份中加入a mL 1mol/LBaCl2溶液能使SO42-沉淀完全,a=
分析:(1)实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水;
(2)在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气,依据电荷守恒和原子守恒配平写出离子方程式;
(3)CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,依据原子守恒配平化学方程式;
(4)①100mL AlCl3与MgSO4的混合溶液,向其中一份中加入10mL 4mol/L的氨水,恰好完全反应铝离子和镁离子全部恰好沉淀,继续加入氢氧化钠溶液,氢氧化铝沉淀溶解剩余的沉淀为氢氧化镁沉淀,依据离子方程式计算;
②依据①计算得到溶液中硫酸根离子物质的量等于镁离子物质的量,结合Ba2++SO42-=BaSO4↓计算得到.
(2)在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气,依据电荷守恒和原子守恒配平写出离子方程式;
(3)CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,依据原子守恒配平化学方程式;
(4)①100mL AlCl3与MgSO4的混合溶液,向其中一份中加入10mL 4mol/L的氨水,恰好完全反应铝离子和镁离子全部恰好沉淀,继续加入氢氧化钠溶液,氢氧化铝沉淀溶解剩余的沉淀为氢氧化镁沉淀,依据离子方程式计算;
②依据①计算得到溶液中硫酸根离子物质的量等于镁离子物质的量,结合Ba2++SO42-=BaSO4↓计算得到.
解答:解:(1)实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,反应的化学方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气,依据电荷守恒和原子守恒配平写出离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)“地康法”制氯气,这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为:4HCl+O2
2Cl2↑+2H2O,
故答案为:4HCl+O2
2Cl2↑+2H2O;
(4)①向其中一份中加入10mL 4mol/L的氨水,恰好完全反应反应为A13++3NH3?H2O=Al(OH)3↓+3NH4+;Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+;继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是Al(OH)3+OH-=AlO2-+2H2O,计算得到氢氧化铝物质的量为0.01mol,消耗一水合氨物质的量0.03mol,所以沉淀镁离子的一水合氨物质的量为0.01mol,镁离子物质的量为0.005mol,生成氢氧化镁沉淀物质的量为0.005mol,
故答案为:A13++3NH3?H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-=AlO2-+2H2O;0.005mol;
②依据①计算得到镁离子物质的量为0.005mol,原混合溶液中含有硫酸根离子物质的量为0.005mol,依据Ba2++SO42-=BaSO4↓计算得到
L×0.1mol/L=0.005mol,a=50,故答案为:50.
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气,依据电荷守恒和原子守恒配平写出离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)“地康法”制氯气,这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为:4HCl+O2
| CuCl2 | ||
|
故答案为:4HCl+O2
| CuCl2 | ||
|
(4)①向其中一份中加入10mL 4mol/L的氨水,恰好完全反应反应为A13++3NH3?H2O=Al(OH)3↓+3NH4+;Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+;继续加入l mol/L NaOH溶液至10mL时,沉淀不再减少,沉淀减少的离子方程式是Al(OH)3+OH-=AlO2-+2H2O,计算得到氢氧化铝物质的量为0.01mol,消耗一水合氨物质的量0.03mol,所以沉淀镁离子的一水合氨物质的量为0.01mol,镁离子物质的量为0.005mol,生成氢氧化镁沉淀物质的量为0.005mol,
故答案为:A13++3NH3?H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-=AlO2-+2H2O;0.005mol;
②依据①计算得到镁离子物质的量为0.005mol,原混合溶液中含有硫酸根离子物质的量为0.005mol,依据Ba2++SO42-=BaSO4↓计算得到
| a |
| 1000 |
点评:本题考查了化学方程式、离子方程式书写,镁、铝及其化合物性质的计算应用,分析过程,掌握物质性质是解题关键,题目难度中等.

练习册系列答案
相关题目
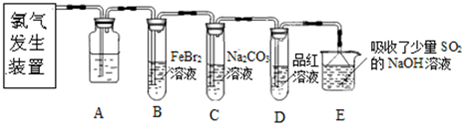
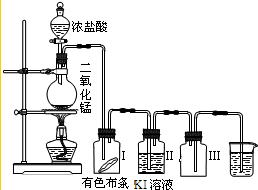 某同学实验室用下列装置探究氯气的性质.
某同学实验室用下列装置探究氯气的性质.