题目内容
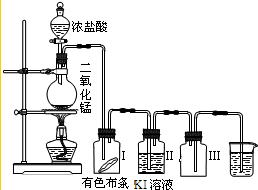 某同学实验室用下列装置探究氯气的性质.
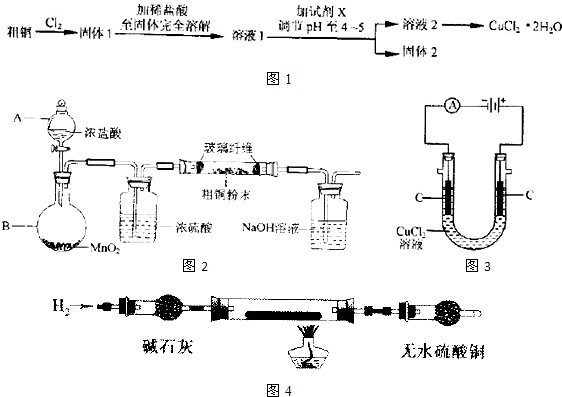
某同学实验室用下列装置探究氯气的性质.(1)实验室用二氧化锰和浓盐酸反应制取氯气,同时生成二氯化锰和水,写出该反应的化学方程式并用单线桥标出电子转移的方向和数目
(2)实验时发现有色布条褪色,其原因是
(3)烧杯中溶液的作用是
分析:(1)由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移;
(2)氯气无漂白性,制备的氯气中含有水蒸气,遇到有色布条会褪色,广口瓶Ⅱ中分离固体碘单质,需要从溶液中萃取分液后蒸馏;
(3)氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,装置Ⅲ的作用是防倒吸作用.
(2)氯气无漂白性,制备的氯气中含有水蒸气,遇到有色布条会褪色,广口瓶Ⅱ中分离固体碘单质,需要从溶液中萃取分液后蒸馏;
(3)氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,装置Ⅲ的作用是防倒吸作用.
解答:解:(1)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: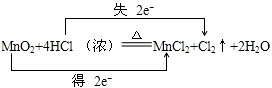 ,
,
故答案为: ;
;
(2)氯气无漂白性,制备的氯气中含有水蒸气,遇到有色布条会褪色,广口瓶Ⅱ中分离固体碘单质,需要从溶液中萃取分液后蒸馏,
故答案为:氯气不干燥;萃取、分液;
(3)氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,装置Ⅲ的作用是防倒吸作用,故答案为:吸收多余的氯气;防止倒吸.
 ,
,故答案为:
 ;
;(2)氯气无漂白性,制备的氯气中含有水蒸气,遇到有色布条会褪色,广口瓶Ⅱ中分离固体碘单质,需要从溶液中萃取分液后蒸馏,
故答案为:氯气不干燥;萃取、分液;
(3)氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,装置Ⅲ的作用是防倒吸作用,故答案为:吸收多余的氯气;防止倒吸.
点评:本题考查了实验室制备氯气的过程分析和氯气的性质应用,氧化还原反应电子转移的标注,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
如图1所示是实验室中制取气体的一种简易装置.

(1)请简述检验它的气密性的方法 .
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件) 气体.
(3)某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为 (计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和 .
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是 .B装置烧杯中液体的作用是 .当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是 .
a.HNO3的氧化性比KNO3弱
b.反应的温度不够
c.HNO3的热稳定性比KNO3差
d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/L KSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/L KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写表中实验报告:

(1)请简述检验它的气密性的方法
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)
(3)某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH
| 高温 |
a.HNO3的氧化性比KNO3弱
b.反应的温度不够
c.HNO3的热稳定性比KNO3差
d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/L KSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/L KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写表中实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试 管中滴入几滴KSCN溶液. |
|
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
如图1所示是实验室中制取气体的一种简易装置.

(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为 .
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为 (计算结果保留两位小数).若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、 .
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是 .B装置烧杯中液体的作用是 .当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.

(1)请简述检验它的气密性的方法.
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.
(3)已知16.9%稀硝酸的密度为1.10g?cm-3,则其物质的量浓度为
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是
(5)现有仪器和药品:试管和胶头滴管,0.1mol?L-1 KSCN溶液、0.2mol?L-1酸性KMnO4溶液、0.1mol?L-1 KI溶液、氯水等.请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告.
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
(13分)某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.
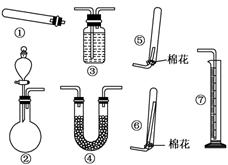
(1)若用装置①制取NH3,其反应的化学方程式为_______________________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是________________________________________.
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是_____________________,分液漏斗中装的试剂是_________________,收集装置应选择________(填装置序号).
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积(标准状况)如下表:
试剂:6.0 g Ca(OH)2(s,过量),6.0 g CaO(s,过量),5.4 g NH4Cl(s),5.4 g (NH4)2SO4(s).
|
试剂组合 |
①Ca(OH)2 NH4Cl |
②Ca(OH)2(NH4)2SO4 |
③CaO NH4Cl |
④CaO(NH4)2SO4 |
|
NH3体积( mL) |
1344 |
1364 |
1792 |
1753 |
从表中数据分析,实验室制氨气的产率(产率=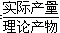 ×100%)最高的是________(填序号),其原因是_____________________________________________________________
×100%)最高的是________(填序号),其原因是_____________________________________________________________

 ,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置
,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置