题目内容
(2013?闸北区二模)氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
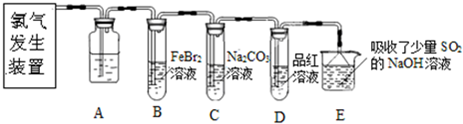
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
(2)装置A中盛有的试剂是
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设.假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-.
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.
a.3mol/L H2SO4 b.0.01mol/L KMnO4c.1mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加少量
步骤三:向B试管中滴加少量

(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
分液漏斗、酒精灯
分液漏斗、酒精灯
;(2)装置A中盛有的试剂是
饱和食盐水
饱和食盐水
,作用是除去氯气中的氯化氢
除去氯气中的氯化氢
.(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是
实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取
实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取
(填操作方法).某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设.假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-.
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是
SO32-和ClO-因发生氧化还原反应,故不能共存
SO32-和ClO-因发生氧化还原反应,故不能共存
.(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.
a.3mol/L H2SO4 b.0.01mol/L KMnO4c.1mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加少量
b
b
(填序号),若溶液褪色
褪色
(填现象),则假设1成立.步骤三:向B试管中滴加少量
d
d
(填序号),若溶液变蓝色
变蓝色
(填现象),则假设2成立.分析:(1)二氧化锰和浓盐酸反应制取氯气加热需酒精灯,加浓盐酸时需要分液漏斗;
(2)装置A的作用是利用饱和食盐水除去氯气中的氯化氢;
(3)氯气具有很强的氧化性,能够和具有较强还原性的Fe2+发生反应;FeBr2与Cl2发生氧化还原反应,溴化亚铁中的二价铁先被氧化;
(4)三价铁离子和硫氰酸钾溶液反应生成血红色溶液;生成的溴单质可以利用四氯化碳萃取的现象来分析发生了反应;
(5)ClO-中+1价的氯具有强氧化性,SO32-中+4价的硫具有还原性;
(6)步骤二:KMnO4 具有强氧化性,SO32-中+4价的硫具有还原性;
步骤三:淀粉遇到碘单质显蓝色.
(2)装置A的作用是利用饱和食盐水除去氯气中的氯化氢;
(3)氯气具有很强的氧化性,能够和具有较强还原性的Fe2+发生反应;FeBr2与Cl2发生氧化还原反应,溴化亚铁中的二价铁先被氧化;
(4)三价铁离子和硫氰酸钾溶液反应生成血红色溶液;生成的溴单质可以利用四氯化碳萃取的现象来分析发生了反应;
(5)ClO-中+1价的氯具有强氧化性,SO32-中+4价的硫具有还原性;
(6)步骤二:KMnO4 具有强氧化性,SO32-中+4价的硫具有还原性;
步骤三:淀粉遇到碘单质显蓝色.
解答:解:(1)二氧化锰和浓盐酸反应制取氯气的方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,从方程式可知该反应需加热,需酒精灯,反应物浓盐酸的滴加以及防氯气的逸出需分液漏斗,故答案为:分液漏斗、酒精灯;
(2)当含氯化氢的氯气通过饱和食盐水时,氯化氢溶解在其中,氯气几乎不溶,故答案为:饱和食盐水;除去氯气中的氯化氢杂质;
(3)若D中品红溶液褪色,说明经过D中有氯气,经过D中有氯气说明B装置中,溴化亚铁中的二价铁和溴离子均被氧化,发生反应的离子方程式为2Fe2++4Br-+3Cl2→2Fe3++6Cl-+2Br2,故答案为:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2;
(4)因FeBr2与Cl2发生氧化还原反应,溴化亚铁中的二价铁先被氧化,所以只须证明有三价铁存在即可,KSCN溶液可与三价铁形成血红色的硫氰化铁可证明有三价铁存在,或证明有溴单质生成,故答案为:实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取;
(5)ClO-中+1价的氯具有强氧化性,SO32-中+4价的硫具有还原性,ClO-与SO32-会发生氧化还原反应,
故答案为:SO32-和ClO-因发生氧化还原反应,故不能共存;
(6)步骤二:KMnO4 具有强氧化性与具有还原性的SO32-发生氧化还原反应KMnO4褪色,故答案为:b;褪色;
步骤三:ClO-中+1价的氯具有强氧化性,能将碘化钾中-1价的碘氧化成碘单质.淀粉遇到碘单质显蓝色,故答案为:d;变蓝色.
| ||
(2)当含氯化氢的氯气通过饱和食盐水时,氯化氢溶解在其中,氯气几乎不溶,故答案为:饱和食盐水;除去氯气中的氯化氢杂质;
(3)若D中品红溶液褪色,说明经过D中有氯气,经过D中有氯气说明B装置中,溴化亚铁中的二价铁和溴离子均被氧化,发生反应的离子方程式为2Fe2++4Br-+3Cl2→2Fe3++6Cl-+2Br2,故答案为:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2;
(4)因FeBr2与Cl2发生氧化还原反应,溴化亚铁中的二价铁先被氧化,所以只须证明有三价铁存在即可,KSCN溶液可与三价铁形成血红色的硫氰化铁可证明有三价铁存在,或证明有溴单质生成,故答案为:实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取;
(5)ClO-中+1价的氯具有强氧化性,SO32-中+4价的硫具有还原性,ClO-与SO32-会发生氧化还原反应,
故答案为:SO32-和ClO-因发生氧化还原反应,故不能共存;
(6)步骤二:KMnO4 具有强氧化性与具有还原性的SO32-发生氧化还原反应KMnO4褪色,故答案为:b;褪色;
步骤三:ClO-中+1价的氯具有强氧化性,能将碘化钾中-1价的碘氧化成碘单质.淀粉遇到碘单质显蓝色,故答案为:d;变蓝色.
点评:本题考查了氯气的性质和实验室制备,解题关键在于理解制取的原理以及灵活运用氯气的性质等相关知识解答问题,题目综合性强,难度较大.

练习册系列答案
相关题目