题目内容
5.在实验室里,下列除去杂质的方法正确的是( )①溴苯中混有溴:加入KI溶液,用汽油萃取出溴;
②除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
③硝基苯中混有浓硝酸和浓硫酸:将其倒入浓烧碱溶液中,静置,然后分液;
④乙烯中混有CO2:将其通入浓氢氧化钠溶液洗气后干燥;
⑤除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①③⑤ | B. | ②③⑤ | C. | ①④⑤ | D. | ③④⑤ |
分析 ①汽油和苯混溶;
②氯气和乙烷发生取代反应;
③浓硝酸和浓硫酸可与氢氧化钠反应,而硝基苯不反应,且不溶于水;
④乙烯与氢氧化钠不反应;
⑤乙醇与生石灰不反应.
解答 解:①汽油和苯混溶,应用氢氧化钠溶液除杂,故错误;
②氯气和乙烷发生取代反应,应用溴水除杂,故错误;
③浓硝酸和浓硫酸可与氢氧化钠反应,而硝基苯不反应,且不溶于水,可用氢氧化钠溶液除杂,故正确;
④乙烯与氢氧化钠不反应,可用于除杂,故正确;
⑤乙醇与生石灰不反应,乙酸与生石灰反应生成难挥发的乙酸钙,进而用蒸馏的方法分离,故正确.
故选D.
点评 本题考查物质的分离和提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,难度不大,注意把握物质的性质异同,除杂时不能引入新的杂质,更不能影响被提纯的物质的性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.某元素的最高价氧化物的分子式RO2,其中含R27.27%.对此元素的叙述不正确的是( )
| A. | 该元素为碳 | B. | 该元素的气态氢化物含H 25% | ||
| C. | RO2为极性分子 | D. | RO2与水反应能生成酸 |
16.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子半径大于y的原子半径 | B. | x的电负性大于y的电负性 | ||
| C. | x的能层数等于y的能层数 | D. | x的第一电离能小于y的第一电离能 |
10.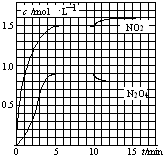 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
| A. | 前5min反应的平均速率v(N2O4)=0.36mol•(L•min)-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 反应①、②均为吸热反应 | |
| D. | 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
14.以下有关原子结构及元素周期律的叙述中正确的是( )
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 同主族元素的简单阴离子还原性越强,水解程度越大 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
15.我国酸雨形成的主要原因是( )
| A. | 汽车排出的大量尾气 | B. | 自然界中硫化物的分解 | ||
| C. | 工业上大量燃烧含硫的燃料 | D. | 制硝酸厂排出的大量尾气 |
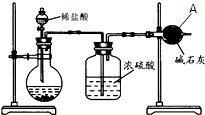 为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)
为测定碳酸钙的纯度(杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.(相对原子质量:C=12 O=16 Ca=40)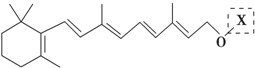 在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用.为了研究X的结构,将化合物A在一定条件下水解只得到B(
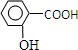
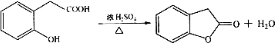
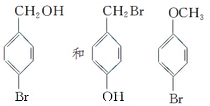
在研究其性能的过程中,发现结构片段X对化合物A的性能起了重要作用.为了研究X的结构,将化合物A在一定条件下水解只得到B(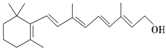 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.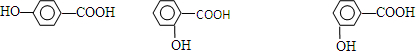 .
. .
. .
. .
.