题目内容
【题目】高铁酸钠(Na2FeO4)是一种新型高效多功能净水剂,电解浓NaOH溶液制备高铁酸钠的装置如图①所示。下列说法不正确的是( )

A. X为电源负极,铁电极发生的电极反应式是:Fe - 6e- + 8OH- = FeO42- + 4H2O
B. 离子交换膜为阳离子交换膜
C. 当生成1.66 gNa2FeO4时,收集到的气体在标准状况下的体积是672 mL
D. NaOH溶液的初始浓度与电解后生成的Na2FeO4浓度的变化关系如图②所示,c(Na2FeO4)降低的原因可能是发生了副反应
【答案】B
【解析】
根据电解池,电解原理,电极反应式的书写,化学反应速率计算,盐类水解等相关知识分析解答。
A.图①中,Fe作阳极失去电子,即Y是正极,所以X是负极,阳极发生的电极方程式为:Fe - 6e- + 8OH- = FeO42- + 4H2O,故A正确;
B. 铁是阳极,电极反应式为Fe-6e-+8OH-═FeO42-+4H2O,Ni电极上氢离子放电,电极反应式为2H2O+2e-═H2↑+2OH-,图①中的离子交换膜为阴离子交换膜,OH-自左向右移动,电解时阳极区pH降低、阴极区pH升高,故B错误;
C.X电极这边的电极方程式是:6H2O+6e-=3H2↑+6OH-,即生成氢气,总反应方程式为:Fe+2OH-+2H2O=FeO42-+3H2↑,1.66 gNa2FeO4即为0.01mol,根据化学计量关系可得到n(H2)=0.03mol,标况下体积为672mL,故C正确;
D. Na2FeO4只在强碱性条件下稳定,当c(OH-)降低,Na2FeO4稳定性变差,且反应慢,当c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低,故D正确。
故选B。

【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
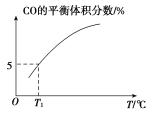
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)写出H2CO3的电离方程式:______________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______________________(填宇母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)·c(OH-) D. 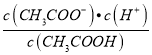
若该溶液升髙温度,上述4种表达式的数据增大的是_________________________。
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
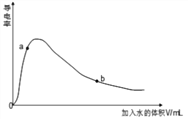
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同, 则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
【题目】某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:

(1)0~8 min,v(CO2)=__________mol·L-1·min-1。
(2)该反应在恒温恒容的密闭容器中进行,能说明该反应达到化学平衡状态的是_____
A、单位时间内 ,每消耗1molCO2同时生成1molCO
B、容器内气体的压强不再随时间变化
C、容器内气体的密度不再随时间变化
D、容器内气体的平均相对分子质量不再随时间变化
(3)计算该温度下,反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数__________
FeO(s)+CO(g)的平衡常数__________
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是________(填序号)。
A、温度 B、铁粉的量(足量) C、压强 D、CO的量
(5)已知:反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
②根据表中数据,计算反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。
CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。
【题目】下表是元素周期表简化后的一部分,请用标出的元素以及对应的物质回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | ① | ||||||
2 | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ |
(1)写出由①和③两种元素组成的不带电的两种物质的化学式:________、_______;
(2)①~⑩号元素中最高价氧化物对应的水化物酸性最强的酸的化学式为:_______;
(3)⑩的最高价氧化物对应的水化物与⑧的最高价氧化物在加热的条件下生成盐和水的化学方程式为:___________________________________________________________;
(4)将⑤的单质通入④的常规氢化物中,反应剧烈,对应的化学方程式为:________;
(5)相同条件下⑤⑥⑦⑧四种元素的原子半径由大到小的顺序是:________________。
