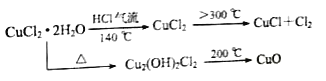
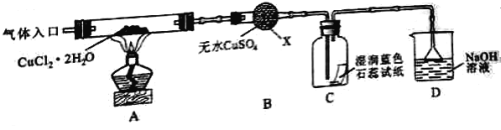
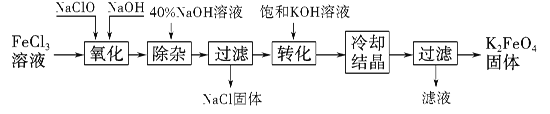
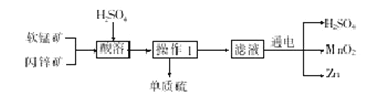
题目内容
【题目】(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于______________;
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______________(填“极性”或“非极性”)分子.
(3)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4______________H3PO4; HClO4______________HClO3;
(4)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
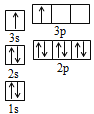
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了______________;
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______________。
【答案】
(1)水分子间存在氢键;
(2)非极性;
(3)>;>;
(4)①能量最低原理;②直线形
【解析】
试题分析:(1)H2O与H2S都属于分子晶体,H2O分子间可以形成氢键,H2S只含有范德华力,所以水的沸点高于H2S的沸点,故答案为:水分子间存在氢键;
(2)非极性分子的溶质极易溶于非极性分子的溶剂,CCl4、CS2是非极性分子,CrO2Cl2能与CCl4、CS2等互溶,所以CrO2Cl2是非极性分子,故答案为:非极性;
(3)H2SO4和H3PO4分别为S、P元素的最高价氧化物对应的水化物,非金属性S>P,则酸性H2SO4>H3PO4;HClO4和HClO3都是Cl元素的含氧酸,Cl元素的化合价越高,酸性越强,则酸性:HClO4>HClO3,故答案为:>;>;
(4)①表中A、B两原子的第二、三电离能之间都有1个突跃,说明它们属于ⅡA族,又它们都是短周期元素,且A的第一电离能比B大,因此,A为Be元素,B为Mg元素,图1所示电子排布,根据能量最低原理,最外层两个电子应全排在s轨道上,故答案为:能量最低原理;
②A和氯元素形成的简单分子为BeCl2,BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线形,故答案为:直线形。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】
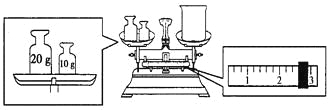
(1)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为 g,要完成本实验该同学应称出 g NaOH。
(2)使用容量瓶前必须进行的一步操作是 。
(3)在配制过程中,其他操作都是正确的,下列操作会引起配制浓度偏高的是 。
A.转移溶液时不慎有少量洒到容量瓶外面 |
B.定容时俯视刻度线 |
C.未冷却到室温就将溶液转移到容量瓶并定容 |
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线 |