题目内容
11.若在铜片上镀银时,下列叙述正确的是( )①将铜片接在电池的正极上 ②将银片接在电源的正极上
③需用CuSO4溶液作电解液 ④在银片上发生的反应是:4OH--4e-═O2↑+2H2O
⑤需用AgNO3溶液作电解液 ⑥在铜片上发生的反应是:Ag++e-═Ag.
| A. | ①③⑥ | B. | ②③④⑥ | C. | ①④⑤⑥ | D. | ②⑤⑥ |
分析 若在铜片上镀银时,铜做电解池的阴极与电源负极相连,电解质溶液中的银离子得到电子发生还原反应生成银;银做电解池的阳极和电源正极相连,铜失电子发生氧化反应生成铜离子;电解质溶液为硝酸银溶液.
解答 解:阳极电镀原理,若在铜片上镀银时,铜做电解池的阴极与电源负极相连,电解质溶液中的银离子得到电子发生还原反应生成银;银做电解池的阳极和电源正极相连,铜失电子发生氧化反应生成铜离子;电解质溶液为硝酸银溶液;
①将铜片应接在电源的负极上,故①错误;
②将银片应接在电源的正极上,故②正确;
③用硫酸铜溶液为电镀液,阴极析出铜,故③错误;
④在银片上发生的反应是:2Ag++2e-→2Ag,故④错误;
⑤需用硝酸银溶液为电镀液.故⑤正确;
⑥在铜片上发生的反应是:2Ag++2e-→2Ag,故⑥正确;
故选D.
点评 本题考查了电解原理的应用,电镀池的工作原理分析,电极判断、电解名称、电极反应,题目较简单.

练习册系列答案
相关题目
1.现有甲、乙两个图象,能同时满足两个图象的热化学方程式的是( )


| A. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | 4NH3(g)+5O2(g)?4NO+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
2.下列所得溶液的物质的量浓度等于0.1mol/L的是( )
| A. | 将标准状况下22.4LHCl气体充分溶解在 1 L水中 | |
| B. | 将10克质量分数为98%的H2SO4与990克H2O | |
| C. | 将8克SO3溶于水并配成1L溶液 (已知:SO3+H2O═H2SO4) | |
| D. | 将0.1molNa2O溶于2 LH2O中(已知:Na2O+H2O═2NaOH) |
6. 如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中一定还含有手性碳原子的是( )
如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中一定还含有手性碳原子的是( )
 如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中一定还含有手性碳原子的是( )
如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中一定还含有手性碳原子的是( )| A. | 发生酯化反应 | B. | 发生加成反应 | C. | 发生银镜反应 | D. | 发生水解反应 |
3.关于化学反应速率和化学平衡的说法正确的是( )
| A. | 对于一定条件下已平衡的可逆反应,增加反应物的物质的量,正反应速率一定增大 | |
| B. | 改变外界条件使化学反应速率发生改变,则化学平衡一定发生移动 | |
| C. | 催化剂能改变活化分子百分数,所以一定可以改变化学反应速率和化学平衡 | |
| D. | 升高温度,正、逆反应速率均增大,平衡向吸热反应方向移动 |
20.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
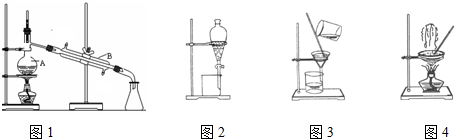
装置图1中A的名称是蒸馏烧瓶,B的名称是冷凝管.A 中一般要加入碎瓷片,其作用是防止暴沸.装置图4中盛溶液的仪器名称是蒸发皿.

装置图1中A的名称是蒸馏烧瓶,B的名称是冷凝管.A 中一般要加入碎瓷片,其作用是防止暴沸.装置图4中盛溶液的仪器名称是蒸发皿.
1.下列溶液中各微粒的浓度关系不正确的是( )
| A. | 0.1mol/LHCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| B. | 1L0.1mol•L-1 CuSO4•(NH4)2SO4•6H2O的溶液中:c(${SO}_{4}^{2-}$)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1mol/LNaHCO3溶液中:c(H+)+c(H2CO3)=c(${CO}_{3}^{2-}$)+c(OH-) | |
| D. | 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性:c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+) |

 .
. .
. ,名称是2-甲基-2-丁醇.
,名称是2-甲基-2-丁醇.