题目内容
19.石墨在材料领域有重要应用.某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质.设计的提纯和综合应用工艺如下:
(注:SiCl4的沸点是57.6°C,金属氯化物的沸点均高于150°C)
(1)Si的原子结构示意图是
 .
.(2)下列说法正确的是abc.
a.酸性:H2CO3>H2SiO3 b.原子半径:O<Si
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(3)向反应器中通入Cl2前,需通一段时间的N2,主要目的是通入氮气排尽装置中的空气,防止石墨发生氧化反应,减少石墨损失.
(4)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物.气体I中的氯化物主要为SiCl4.由气体II中某物质得到水玻璃的化学方程式为SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O.
(5)步骤①为:搅拌、过滤.所得溶液IV中阴离子有AlO2-、OH-、Cl-.
(6)由溶液IV生成沉淀V的总反应的离子方程式为AlO2-+CH3COOCH2CH3+2H2O$\stackrel{△}{→}$CH3COO-+CH3CH2OH+Al(OH)3↓.
分析 高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,固体Ⅲ存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,过滤得到的溶液中含有偏铝酸钠、过量的氢氧化钠,在溶液中加入乙酸乙酯,加热,乙酸乙酯发生水解,消耗了氢氧化钠,溶液碱性减弱,促进了偏铝根水解,生成氢氧化铝沉淀,据此答题.
解答 解:高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,固体Ⅲ存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,过滤得到的溶液中含有偏铝酸钠、过量的氢氧化钠,在溶液中加入乙酸乙酯,加热,乙酸乙酯发生水解,消耗了氢氧化钠,溶液碱性减弱,促进了偏铝根水解,生成氢氧化铝沉淀,
(1)Si是14号元素,原子核外有三个电子层,原子结构示意图是 ,故答案为:
,故答案为: ;
;
(2)a.碳的非金属性强于硅,所以酸性:H2CO3>H2SiO3,故a正确;
b.硅有三个电子层,氧只有两个电子层,所以原子半径:O<Si,故b正确;
c.元素非金属性越强,氢化物越稳定,所以稳定性:H2O>CH4>SiH4,故c正确;
d.电子层数相同,核电荷数越多,半径越小,所以离子半径:O2->Al3+,故d错误,
故选:abc;
(3)石墨化学性质在常温下稳定,而在高温下可与氧气发生反应,所以通入氮气排尽装置中的空气,防止石墨发生氧化反应,减少石墨损失,
故答案为:通入氮气排尽装置中的空气,防止石墨发生氧化反应,减少石墨损失;
(4)石墨过量高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中氯化物主要为SiCl4,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,化学反应方程式为:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O,
故答案为:SiCl4;SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
(5)金属氯化物的沸点均高于150℃,则固体Ⅲ中存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,搅拌、过滤得到溶液IV,故溶液IV中的阴离子有:AlO2-、OH-、Cl-,
故答案为:过滤;AlO2-、OH-、Cl-;
(4)偏铝酸钠发生水解,加入乙酸乙酯除去过量的氢氧化钠,且加热条件下水解平衡一直正向移动,得到氢氧化铝沉淀、醋酸钠、乙醇,由溶液IV生成沉淀V的总反应的离子方程式为:AlO2-+CH3COOCH2CH3+2H2O$\stackrel{△}{→}$CH3COO-+CH3CH2OH+Al(OH)3↓,
故答案为:AlO2-+CH3COOCH2CH3+2H2O$\stackrel{△}{→}$CH3COO-+CH3CH2OH+Al(OH)3↓.
点评 本题考查物质制备分离、阅读题目获取信息能力、化学方程式及离子方程式书写等,需要学生具备扎实的基础及迁移运用能力,难度中等.

| A. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 三氧化二铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 铝与氢氧化钠溶液反应:2AI+2OH-═2 AIO2-+H2↑ | |
| D. | 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
①将铜片接在电池的正极上 ②将银片接在电源的正极上
③需用CuSO4溶液作电解液 ④在银片上发生的反应是:4OH--4e-═O2↑+2H2O
⑤需用AgNO3溶液作电解液 ⑥在铜片上发生的反应是:Ag++e-═Ag.
| A. | ①③⑥ | B. | ②③④⑥ | C. | ①④⑤⑥ | D. | ②⑤⑥ |

(1)证明步骤1所加FeCl3溶液过量的方法是取步骤1反应后的溶液于试管中,滴加KSCN溶液少许,若溶液呈红色说明氯化铁溶液过量.
(2)步骤2所加的氧化剂最适宜的是B(填字母).A.HNO3 B.H2O2 C.KMnO4
(3)步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是CuO(写出一种即可).
(4)已知表格数据:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-29 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(Cl-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>7:3
C.向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuCl2溶液
D.在pH=5的溶液中Fe2+不能大量存在
(5)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是CuCl2溶液水解生成氢氧化铜和盐酸,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸抑制氯化铜的水解(用化学方程式结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2•2H2O.
| A. | 液溴易挥发,应用少量的水液封并放在冷暗处保存 | |
| B. | 硝酸见光易分解、易挥发,应用棕色广口试剂瓶密封保存 | |
| C. | 金属钠遇到氧气和水均立即反应,应保存在煤油中或者液体石蜡里 | |
| D. | 碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存 |

 ;
; _,反应类型是消去反应;
_,反应类型是消去反应; (其中任一种);(任写一种)
(其中任一种);(任写一种)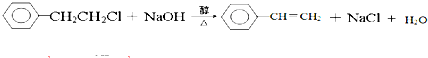 .
.
 .
.