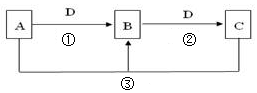
��Ŀ����
��14�֣�ij��ѧ��ȤС��ͬѧչ����Ư���������ƣ�NaClO2�����о���
ʵ�����ȡNaClO2����
��֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2?3H2O������38��ʱ�����������NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��Ba(ClO)2������ˮ��
������ͼ��ʾװ�ý���ʵ�顣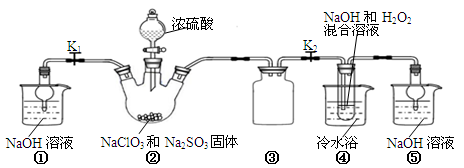
��1��װ�âٵ������� װ�â۵������� ��
��2��װ�â��в���ClO2�Ļ�ѧ����ʽΪ ��
��3����װ�âܷ�Ӧ�����Һ��þ���NaClO2�IJ�������Ϊ��
�ټ�ѹ��55�������ᾧ���ڳ��ȹ��ˣ��� ���ܵ���60�����õ���Ʒ��
��4�����ʵ���������NaClO2�����Ƿ�������Na2SO4�������������ǣ�ȡ����������������ˮ�� ��
ʵ��ⶨij����������Ʒ�Ĵ��ȡ�
�������ʵ�鷽����������ʵ�飺
��ȷ��ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ����֪��ClO2��+ 4I��+4H+ =2H2O+2I2+Cl�����������û��Һ���100mL������Һ��
����ȡ25.00mL������Һ����ƿ�У���c mol?L-1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ�������ı���Һ�������ƽ��ֵΪV mL����֪��I2 +2S2O32��=2I��+S4O62������
��5���ζ���ʹ�õ�ָʾ���� ���ﵽ�ζ��յ�ʱ������Ϊ ��
��6�� ��Ʒ��NaClO2����������Ϊ ���ú�m��c��V�Ĵ���ʽ��ʾ��ʽ����NaClO2 90.5����
��1�����ն����ClO2���壬��ֹ��Ⱦ����(1��)
��ֹ����(������ȫƿ��������ȷ˵��) (1��)
��2��2NaClO3+Na2SO3+H2SO4(Ũ)==2ClO2��+2Na2SO4+H2O(2��)
��3����38�桫60�����ˮϴ��(2�֣���д��ϴ�ӡ���1��)
��4���μӼ���BaCl2��Һ�����а�ɫ�������֣�����Na2SO4�����ް�ɫ�������֣���Na2SO4�� (2�֣���һ�����1��)
��5��������Һ��1�֣�����Һ����ɫ��Ϊ��ɫ�Ұ���Ӳ���ɫ (2�֣�������ӡ���д��1)
��6��  ��
��  (3��)
(3��)
���������������1��װ������δ��Ӧ��ClO2��װ�âٿ�������δ��Ӧ��ClO2����ֹ�ݳ���Ⱦ������װ�â������巴Ӧ��װ����ѹǿ���ͣ�װ�â۷�ֹ������
��2��װ�â��в���ClO2�ķ�Ӧ����������������Һ��������������Ϊ�����ƣ���������ԭΪ�������ȣ���Ӧ�Ļ�ѧ����ʽΪ��2NaClO3+Na2SO3+H2SO4=2ClO2��+2Na2SO4+H2O��
��3������Һ����ȡ���壬һ����������ᾧ�����ˡ�ϴ�ӡ�����ķ�����Ϊ��ֹ��������NaClO2?3H2O��Ӧ���ȹ��ˣ�����Ŀ��Ϣ��֪��Ӧ�����¶�38�桫60�����ϴ�ӣ�����60����
��4������SO42?��Ba2+�ķ�Ӧ��������NaClO2�����Ƿ�������Na2SO4�������������ǣ�ȡ����������������ˮ���μӼ���BaCl2��Һ�����а�ɫ�������֣�����Na2SO4�����ް�ɫ�������֣���Na2SO4��
��5���������۱���ɫ������ָʾ��Ϊ��������Һ����Ӧ����ʱ���ⷴӦ��ȫ���μ����һ��Na2S2O3��Һʱ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��˵������ζ��յ㡣
��6������Ʒ��NaClO2����������Ϊx����NaClO2��2I2��4S2O32-
90.5g 4mol
mxg c mol?L-1��V��10-3L��
����90.5g��mxg=4mol��c mol?L-1��V��10-3L�� �����x=
�����x= ��
��  ��
��
���㣺���⿼�����ʵ��Ʊ���ʵ�鷽������������ۡ�������ԭ��Ӧ�ζ���

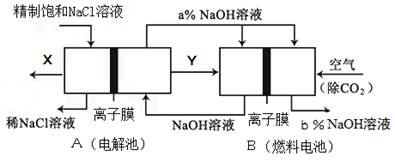
������һ����Ҫ�Ĺ�ҵԭ�ϣ���ҵ������Ĺؼ��ǰ��Ĵ������������Ṥҵ��صĹ����в����ĵ�������Ĵ�����Ӧ��Ҳ�ǿ�ѧ�о����ȵ㡣
I��ͼ10��ͼ11�ֱ���ʵ����ģ��ϳɰ�������������װ��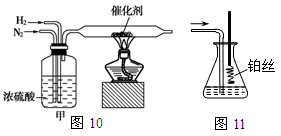
��1������������ͨ��ͼ10װ�ã���װ����Ũ����������ǿ����������ٺ� ��
��2����ͼ11װ������һ��ʱ�䰱����ͨ�������ͬʱ���Ѿ����ȵIJ�˿������װ�õ���ƿ�ڣ���˿���ֺ��ȵ�ԭ���� ��д����װ���а������Ļ�ѧ����ʽ ����Ӧ��������ƿ�ڵ���Һ�к���H����OH���� ���ӡ� ���ӡ�
II�������й�������ʵ�Ľ��ͺ�������
| A��Ũ����ͨ����������ɫ���Լ�ƿ�У�˵��Ũ����ȶ� |
| B����������ϡ���ᷴӦ����Һ��dz��ɫ��˵��ϡ����������������� |
| C������Ũ������ͭм��Ӧ����ȡ����ͭ��˵��Ũ������лӷ��� |
| D������п��ϡ���ᷴӦ��ȡ������˵��ϡ�����ܽ�п�ۻ� |
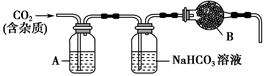
��1����ҵ�ϳ���Na2CO3��Һ���շ�����NOx ��
��֪��NO������Na2CO3��Һ��Ӧ
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ��
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ��
��������Na2CO3��Һ��ȫ����NOx��ÿ����5.6L����״����CO2��ȫ���ݳ���ʱ������Һ����������10g����NOx�е�xֵΪ ��
��2������Ҳ���������մ���NOx���䷴Ӧԭ��Ϊ��
NO��NO2��H2O��2HNO2
2HNO2��CO(NH2)2��2N2����CO2����3H2O��
�����������NO��NO2��������Ӧ��ϵ����ʱ����Ч����ѡ������������V(NO)��V(NO2)��3��1ʱ����ͨ��һ�����Ŀ�����ͬ��ͬѹ�£�V(����)��V(NO)�� ���������������������ԼΪ20%����
Ϊ�о�ͭ��Ũ����ķ�Ӧ��ij��ѧ��ȤС���������ʵ�顣
ʵ���Ӧ����Ķ���̽����
ʵ��װ����ͼ��ʾ�����̶�װ������ȥ��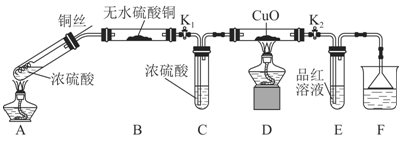
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ ��
��2��F�ձ��е���Һͨ���� ��
��3��ʵ������У���֤��Ũ��������Ԫ�ص�������ǿ����Ԫ�ص�������
��
��4��ʵ�������֤��Aװ���Թ��з�Ӧ���ò����Ƿ���ͭ���ӵIJ��������� ��
��5��Ϊ˵��Ũ�����е�ˮ�Ƿ�Ӱ��Bװ��������жϣ��������һ��ʵ�顣ʵ�鷽��Ϊ ��
ʵ���Ӧ����Ķ���̽��
��6����ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣�������������������ϡ�
����1��
| ����/mol��L��1 | ��ɫ���ʳ��ֵ��¶�/�� | ��ɫ������ʧ���¶�/�� |
| 15 | Լ150 | Լ236 |
| 16 | Լ140 | Լ250 |
| 18 | Լ120 | ����ʧ |
a��ͭ��Ũ���ᷴӦʱ���漰�ķ�Ӧ���ܲ�ֹһ��
b������Ũ��ѡ���ʵ����ɱ����������г��ֺ�ɫ����
c���÷�Ӧ����������֮һ������Ũ�ȡ�15 mol/L
d������Ũ��Խ��ɫ����Խ����֡�Խ����ʧ
��7��Ϊ�������ͭ�IJ��ʣ����÷�Ӧ������Һ�кͺ����Ƴ�250.00 mL��Һ��ȡ����Һ25.00 mL��������KI��Һ���Ե�����ҺΪָʾ������b mol/L Na2S2O3��Һ�ζ����ɵ�I2��3��ʵ��ƽ�����ĸ�Na2S2O3��ҺV mL������Ӧ����ͭ������Ϊa g��������ͭ�IJ���Ϊ _������֪��2Cu2����4I��===2CuI��I2��2S2O
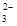 ��I2===S4O
��I2===S4O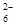 ��2I����
��2I���� ����һ�Թ�NO2��ijͬѧ������±�ʵ�飬�Ծ����ܶ��ʹNO2��ˮ���ա�
��������±���
| ʵ�鲽�� | ʵ������ | ���ͣ��û�ѧ����ʽ��ʾ�� | |
| �� | ������NO2�ĵ�����ʢ��ˮ��ˮ���У���ȥ��Ƥ��������ζ��Թܡ� | �Թ�����������������ɫ��Ϊ��ɫ��Һ���������Թܸ߶ȵ�����������ܿڣ����� | |
| �� | | | |
| �� | �ظ�����ڵIJ������Σ�ֱ��Һ����������Թܡ� | �Թ��ڳ�����ɫҺ�塣 | �ܷ�Ӧ����ʽ�� |

��16�֣�ij�о�С�����о�̼��Ũ����ķ�Ӧ����ʵ��������¡�
| ���� | ���� |
| a���ø���ྻ���ձ�ȡԼ10 mLŨ���ᣬ���ȡ� | |
| b����С���պ��ľ̿Ѹ�������ȵ�Ũ�����С� | ���ȵ�ľ̿���ȵ�Ũ����Ӵ��������ҷ�Ӧ��ͬʱ�д�������ɫ���������Һ����ľ̿Ѹ��ȼ�գ����������� |
��̼��Ũ����ķ�Ӧ��˵��Ũ������� �ԡ�
�ڷ�Ӧ������������ʹ����Ũ�������ȷֽ⣬д����Ӧ�Ļ�ѧ����ʽ ��
��2��ʵ��������Һ����ľ̿Ѹ��ȼ�գ�����������С��ͬѧΪ���о���ȼ������O2����NO2�����������ʵ�顣
��.��ȡNO2���塣
�������߿��ڻ�����ͭ��Ũ������ȡ���ռ�NO2��װ�ü�ͼ(�г�������)��
��NaOH��Һ�����������ն����NO2����Ӧ�����������ʵ�����ȵ����Σ�д���������εĻ�ѧʽ ��
��.̽��ʵ�顣
ʵ��������ڿ�������ȼľ̿��ʹ��ȼ�ղ����л��棬���������ľ̿����ʢ��NO2����ļ���ƿ�С�
ʵ������ľ̿��NO2�����г���ȼ�գ�����Ѹ�ٱ���������ƿ��������ɫ��dzֱ����ɫ��������������ʹ����ʯ��ˮ����ǣ�������������ɫ��
�ٸ���ʵ������д��̼��NO2���巴Ӧ�Ļ�ѧ����ʽ ��
���Է������Ƿ���Ҫ���Ӵ������ľ̿�봿��O2��Ӧ��ʵ�� ��
��ͨ��ʵ��̽��������Ϊ��ȼ������ʲô���������� ��