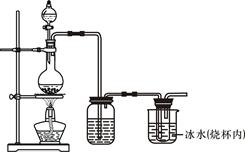
题目内容
现有一试管NO2,某同学设计如下表实验,以尽可能多地使NO2被水吸收。
⑴请完成下表:
| 实验步骤 | 实验现象 | 解释(用化学方程式表示) | |
| ① | 将充满NO2的倒立在盛有水的水槽中,拨去橡皮塞,轻轻晃动试管。 | 试管内气体由 色逐渐变为无色,液面上升至试管高度的 (离管口)处。 | |
| ② | | | |
| ③ | 重复步骤②的操作数次,直至液体充满整个试管。 | 试管内充满无色液体。 | 总反应方程式: |

实验步骤 实验现象 解释(用化学方程式表示) ① 红棕(2分) 2/3(2分) 3NO2+H2O=2HNO3+NO(2分) ② 当试管中液面不再上升时,通过导管缓缓通入少量O2,轻轻晃动试管。
(2分)当通入O2时,试管内气体迅速由无色变成红棕色,液面继续上升,气体又逐渐变为无色。(2分) 2NO+ O2=2NO2
3NO2+H2O=2HNO3+NO(2分)③ 4NO2+O2+2H2O=4HNO3(2分)
⑵ (2分)
(2分)
解析试题分析:①将充满NO2的倒立在盛有水的水槽中,拨去橡皮塞,轻轻晃动试管,由于发生反应:3NO2+ H2O == 2HNO3+ NO ,所以气体会有红棕色变为无色,根据方程式中气体的物质的量的关系可知:液面上升至试管高度的2/3。②当试管中液面不再上升时,通过导管缓缓通入少量O2,轻轻晃动试管,此时在试管内会发生反应:2NO+ O2=2NO2; 3NO2+H2O=2HNO3+NO,所以试管内气体迅速由无色变成红棕色,液面继续上升,气体又逐渐变为无色。③重复步骤②的操作数次,直至液体充满整个试管,试管内充满无色液体将上述两个方程式叠加,就可以得到总方程式是:4NO2+O2+2H2O=4HNO3。⑵此实验的装置简图是 。
。
考点:考查NO2气体被氧气吸收的知识。

(12分)某研究小组欲探究SO2的化学性质,设计了如下实验方案。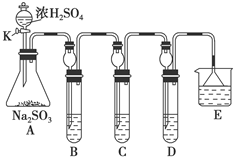
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入 ______ | __________ |
__________________________________________________。
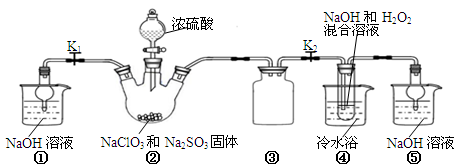
(18分)I.实验室制备、收集干燥的SO2,所需仪器如下。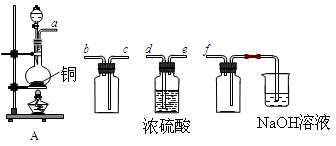
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ ____→ ____ →____→____f。
(2)装置A中发生反应的化学方程式为____________________________________。
(3)验证产生的气体是SO2的方法是________________________________________。
II.SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: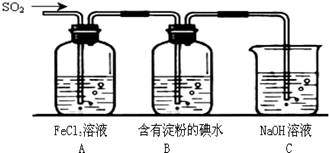
(1)装置A中的现象是__________。在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是_______。
(2)装置C的作用是____________________________________。
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有( )
| A.烧瓶 | B.酒精灯 | C.漏斗 | D.烧杯 E.玻璃棒 |
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是______,原因是___________________________________。
(5)能表明的还原性性弱于SO2的现象是________________________________________。
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。
 5Cl﹣+ ClO3﹣+3H2O
5Cl﹣+ ClO3﹣+3H2O