题目内容
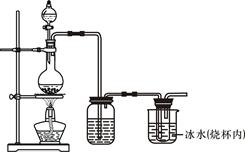
树德中学某化学兴趣小组在实验室用MnO2与浓盐酸反应制备C12(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 序号)。
A.往烧瓶中加入浓盐酸
B.加热
C.往烧瓶中加入MnO2粉末
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,兴趣小组同学提出下列实验探究方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量
乙方案:采用酸碱恰好中和(有指示剂)的方法测定
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量
丁方案:与足量Zn反应,测量生成的H2体积(换算为标准状况)
继而进行下列判断和实验:
①判定甲方案是否可行 (填“是”或“否”),理由是 。
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,滴入0.200 0 mol/L的NaOH溶液,消耗NaOH溶液22.00 mL,该次测得试样中盐酸浓度为 mol·L一1;
b.重复以上操作多次取平均值获得实验结果
③判断丙方案的实验结果 (填“偏大"、“偏小”或“准确”)。
(已知:部分CaCO3会转化为更难溶的MnCO3)
④进行丁方案实验:装置如图所示(夹持器具已略去)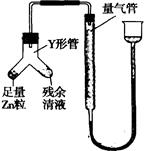
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔l分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)
(1) CAB
(2)①否 (1分) 残余清液中,n(Cl—)>n(H+)(或其它合理答案)
②0.2200
③偏小
④(i)Zn粒 残余清液(全对2分)
(ii)装置内气体尚未冷却至室温
解析试题分析:(1)依据反应物及制取气体的操作步骤分析解答;加药顺序一般是先加入固体药品,再加入液药品,最后再加热.则依次顺序是CAB
(2)二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应且足量AgNO3溶液反应,称量生成的AgCl质量,加入足量的硝酸银溶液只能求出氯离子的量,而不能求出剩余盐酸的浓度。
量取试样20.00mL,用0.2000mol?L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为,由CHClVHCl=CNaOHVNaOH可得出盐酸的浓度为0.2200mol/L;
③丙方案根据题意碳酸锰的Ksp比碳酸钙小,由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小;故答案为:偏小;
④丁同学的方案:将锌转移到残留溶液中,反应完毕后,每间隔1分钟读取气体体积.气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;故答案为:气体未冷却到室温;
考点: 考查了实验室制备氯气的试剂添加顺序,中和滴定的 实验操作和计算应用

碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + =___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①已知: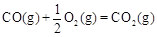 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1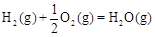 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃
270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。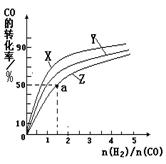
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是 。
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
| | 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ; 且该条件所改变的量是 。
(18分)I.实验室制备、收集干燥的SO2,所需仪器如下。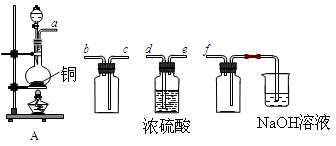
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ ____→ ____ →____→____f。
(2)装置A中发生反应的化学方程式为____________________________________。
(3)验证产生的气体是SO2的方法是________________________________________。
II.SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: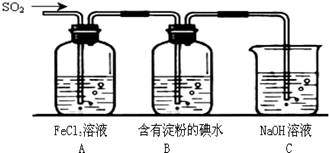
(1)装置A中的现象是__________。在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是_______。
(2)装置C的作用是____________________________________。
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有( )
| A.烧瓶 | B.酒精灯 | C.漏斗 | D.烧杯 E.玻璃棒 |
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是______,原因是___________________________________。
(5)能表明的还原性性弱于SO2的现象是________________________________________。
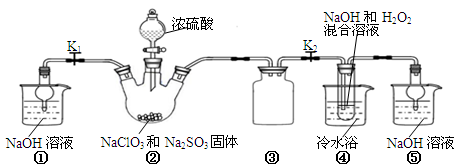
 5Cl﹣+ ClO3﹣+3H2O
5Cl﹣+ ClO3﹣+3H2O