题目内容
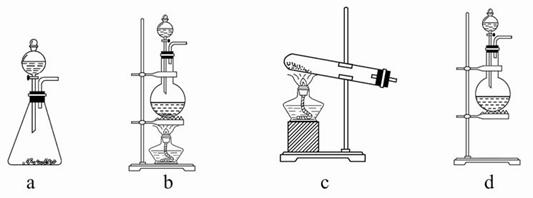
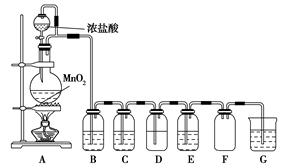
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是 。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是 ,NaHCO3溶液可以吸收 。
(3)上述装置中,B物质是 。用这个实验得到的气体测定CO2的相对分子质量,如果B物质失效,测定结果 (填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出 ,后溶出 。
(6)上述测定实验中,连续 ,说明样品已经恒重。
(1)abc
(2)CuSO4溶液或酸性KMnO4溶液 HCl气体或酸性气体
(3)无水CaCl2偏低
(4)bd
(5)石蜡 CaCO3
(6)两次称量的结果相差不超过(或小于)0.001 g
解析

练习册系列答案
相关题目
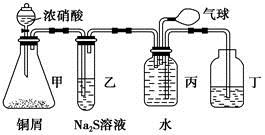
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式 ;
(2)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是 ;
②由实验a、b不能判断白雾中含有HC1,理由是 ;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 ;
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
(4)测定漂粉精有效成分的质量分数。称取2.000 g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3C1O-+ I- ="=" 3C1-+ IO3-
IO3- + 5I-+ 3H2O ="=" 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。

 SiHCl3+H2
SiHCl3+H2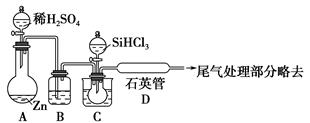
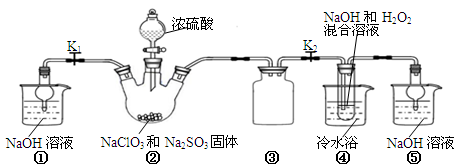
 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。