ЬтФПФкШн
ЁОЬтФПЁПвбжЊЃКввЖўЫсЫзГЦВнЫсЃЈНсЙЙМђЪНЮЊHOOCЁЊCOOHЃЌПЩМђаДЮЊH2C2O4)ЁЃ25ЁцЪБЃЌВнЫсЕФЕчРыЦНКтГЃЪ§ЮЊK1=5.0ЁС10-2ЃЌK2=5.4ЁС10-5ЃЛЬМЫсЃЈH2CO3ЃЉЕФЕчРыЦНКтГЃЪ§ЮЊK1=4.5ЁС10-7ЃЌK2= 4.7ЁС10-11ЁЃВнЫсИЦЕФKsp=4.0ЁС10-8ЃЌЬМЫсИЦЕФKsp=2.5ЁС10-9ЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЯрЭЌЬѕМўЯТЕШЮяжЪЕФСПХЈЖШЕФNa2C2O4ШмвКЕФpHБШNa2CO3ШмвКЕФpH_____ ЃЈЬюЁАДѓЁБЁЂЁАаЁЁБЛђЁАЯрЕШЁБЃЉЃЛ
ЃЈ2ЃЉГЃЮТЯТНЋ20 mL 0.4 mol/LЕФKOHШмвКгы20 mL 0.2 mol/LЕФВнЫсШмвКЛьКЯЃЌдђЛьКЯКѓШмвКжавѕРызгХЈЖШЕФДѓаЁЫГађЮЊ_______________________ЃЛ
ЃЈ3ЃЉ25ЁцЪБЯђ20 mLЬМЫсИЦЕФБЅКЭШмвКжаж№ЕЮМгШы8.0ЁС10-4 mol/LЕФВнЫсМиШмвК20 mLЃЌФмЗёВњЩњГСЕэ________ЃЈЬюЁАФмЁБЛђЁАВЛФмЁБЃЉ.
ЃЈ4ЃЉЫсадKMnO4ШмвКФмгыВнЫсЃЈH2C2O4ЃЉШмвКЗДгІЃЌФГЬНОПаЁзщРћгУЗДгІЙ§ГЬжаШмвКзЯЩЋЯћЪЇПьТ§ЕФЗНЗЈРДбаОПгАЯьЗДгІЫйТЪЕФвђЫиЁЃ
Ђё.ЪЕбщЧАЪзЯШгУХЈЖШЮЊ0.1000molL-1ЫсадKMnO4БъзМШмвКЕЮЖЈЮДжЊХЈЖШЕФВнЫсЁЃ
ЂйИпУЬЫсМиШмвКГЃгУ______ЃЈЬюЁАЯЁСђЫсЁБЁЂЁАЯЁЯѕЫсЁБЁЂЁАЯЁбЮЫсЁБЃЉЫсЛЏЃЌаДГіЕЮЖЈЙ§ГЬжаЗЂЩњЗДгІЕФРызгЗНГЬЪН _____________________________ЁЃ
ЂкЕЮЖЈЙ§ГЬжаВйзїЕЮЖЈЙмЕФЭМЪОе§ШЗЕФЪЧ ______________ЃЈЬюБрКХЃЉЁЃ
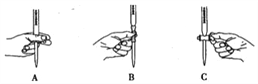
ЂйХаЖЯЕЮЖЈжеЕуЕФЗНЗЈЪЧЃК_________________________________________ЁЃ
ЂкШєХфжЦЫсадKMnO4БъзМШмвКЪБ,ИЉЪгШнСПЦПЕФПЬЖШЯпЃЌЛсЪЙВтЕУЕФВнЫсШмвКХЈЖШ________ЃЈЬюЁАЦЋИпЁБЛђЁАЦЋЕЭЁБЛђЁАВЛБфЁБЃЉЁЃ
Ђђ.ЭЈЙ§ЕЮЖЈЪЕбщЕУЕНВнЫсШмвКЕФХЈЖШЮЊ0.2000molЁЄL-1 ЁЃгУИУВнЫсШмвКАДЯТБэНјааКѓајЪЕбщЃЈУПДЮЪЕбщВнЫсШмвКЕФгУСПОљЮЊ8mLЃЉЁЃ
ЪЕбщБрКХ | ЮТ ЖШЃЈЁцЃЉ | ДпЛЏМСгУСП(g) | ЫсадИпУЬЫсМиШмвК | ЪЕбщФПЕФ a.ЪЕбщ1КЭ2ЬНОП b.ЪЕбщ1 КЭ3 ЬНОПЗДгІЮяХЈЖШЖдИУЗДгІЫйТЪЕФгАЯьЃЛ c.ЪЕбщ1 КЭ4 ЬНОПДпЛЏМСЖдИУЗДгІЫйТЪЕФгАЯьЁЃ | |
ЬхЛ§ЃЈmLЃЉ | ХЈЖШ (molL-1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
ЂйаДГіБэжаa ЖдгІЕФЪЕбщФПЕФ_______________________ЃЛ
ЂкИУаЁзщЭЌбЇЖдЪЕбщ1КЭ3ЗжБ№НјааСЫШ§ДЮЪЕбщЃЌВтЕУвдЯТЪЕбщЪ§ОнЃЈДгЛьКЯеёЕДОљдШПЊЪММЦЪБЃЉЃК
ЪЕбщБрКХ | ШмвКЭЪЩЋЫљашЪБМфЃЈminЃЉ | ||
Ек1 ДЮ | Ек2 ДЮ | Ек3 ДЮ | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
ЗжЮіЩЯЪіЪ§ОнКѓЕУГіЁАЕБЦфЫќЬѕМўЯрЭЌЪБЃЌЫсадИпУЬЫсМиШмвКЕФХЈЖШдНаЁЃЌЭЪЩЋЪБМфОЭдНЖЬЃЌМДЗДгІЫйТЪОЭдНПьЁБЕФНсТлЁЃФГЭЌбЇШЯЮЊИУаЁзщЁАЬНОПЗДгІЮяХЈЖШЖдЫйТЪгАЯьЁБЕФЪЕбщЗНАИЩшМЦжаДцдкЮЪЬтЃЌДгЖјЕУЕНСЫДэЮѓЕФЪЕбщНсТлЃЌЧыМђЪіИФНјЕФЪЕбщЗНАИ________ЁЃ
ЁОД№АИЁП аЁ c (C2O42-) > c (OH-) >c (HC2O4-) ВЛФм ЯЁСђЫс 6H++2MnO4-+5H2C2O4 = 10CO2Ёќ+2Mn2++8H2O A ЕБЕЮШызюКѓвЛЕЮЫсадИпУЬЫсМиШмвКЃЌШмвКЧЁКУгЩЮоЩЋБфЮЊзЯКьЩЋЧвАыЗжжгФкВЛБфЩЋ ЦЋЕЭ ЬНОПЮТЖШЖдИУЗДгІЫйТЪЕФгАЯь ЦфЫќЬѕМўЯрЭЌЪБЃЌРћгУЕШСПЧвЩйСПЕФИпУЬЫсМигыЕШЬхЛ§ВЛЭЌХЈЖШЕФзуСПВнЫсШмвКЗДгІЃЌВтСПШмвКЭЪЩЋЪБМф
ЁОНтЮіЁПЃЈ1ЃЉВнЫсЕФЕкЖўВНЕчРыЦНКтГЃЪ§ДѓгкЬМЫсЕФЕкЖўВНЕчРыЦНКтГЃЪ§ЃЌЕчРыЦНКтГЃЪ§дНаЁЃЌЦфЫсИљРызгЕФЫЎНтГЬЖШдНДѓЃЌЫљвдЬМЫсИљРызгЕФЫЎНтГЬЖШДѓгкВнЫсИљРызгЃЌЕМжТВнЫсФЦЕФpHаЁгкЬМЫсФЦЃЛЃЈ2ЃЉГЃЮТЯТЃЌ0.4mol/LЕФKOHШмвК20mLгы0.2mol/LЕФВнЫсШмвК20mLЧЁКУЗДгІЩњГЩВнЫсФЦЃЌДзЫсИљРызгвзЫЎНтЖјЪЙЦфШмвКГЪМюадЃЌЕЋЕквЛВНЫЎНтДѓгкЕкЖўВНЃЌСНВНЫЎНтЖМЩњГЩЧтбѕИљРызгЃЌЫљвдШмвКжавѕРызгХЈЖШДѓаЁЫГађЪЧc (C2O42-) > c (OH-) >c (HC2O4-)ЃЛЃЈ3ЃЉЬМЫсИЦШмвКжаИЦРызгХЈЖШ=![]() mol/L=5ЁС10-5mol/LЃЌЖўепЛьКЯКѓЃЌИЦРызгХЈЖШ=2.5ЁС10-5mol/LЃЌВнЫсМиЕФХЈЖШЮЊ4.0ЁС10-4 mol/LЃЌЛьКЯКѓc(Ca2+)c(C2O42-)=2.5ЁС10-5 ЁС4.0ЁС10-4=1ЁС10-8ЃМKspЃЈ4.0ЁС10-8ЃЉЃЌЙЪВЛФмВњЩњГСЕэЃЛЂё. ЂйИпУЬЫсМиШмвКГЃгУЯЁСђЫсЫсЛЏЃЌВнЫсЃЈH2C2O4ЃЉШмвКгыЫсадKMnO4ШмвКЗЂЩњбѕЛЏЛЙдЗДгІЃЌВнЫсБЛбѕЛЏЮЊЖўбѕЛЏЬМЃЌИпУЬЫсМиБЛЛЙдЮЊMn2+ ЃЌРызгЗНГЬЪНЮЊЃК6H++2MnO4-+5H2C2O4 = 10CO2Ёќ+2Mn2++8H2OЃЛЂкЫсадИпУЬЫсМибѕЛЏадЧПЃЌЫљвддкИУЪЕбщжабЁдёЫсЪНЕЮЖЈЙмЃЌЕЮЖЈЪБгУзѓЪжЕФДѓФДжИЁЂЪГжИЁЂжажИа§зЊЕЮЖЈЙмЕФа§ШћЃЌЫљвдД№АИбЁAЃЛЂлХаЖЯЕЮЖЈжеЕуЕФЗНЗЈЪЧЃКЕБЕЮШызюКѓвЛЕЮЫсадИпУЬЫсМиШмвКЃЌШмвКЧЁКУгЩЮоЩЋБфЮЊзЯКьЩЋЧвАыЗжжгФкВЛБфЩЋЃЛЂмШєХфжЦЫсадKMnO4БъзМШмвКЪБЃЌИЉЪгШнСПЦПЕФПЬЖШЯпЃЌдђЫљМгеєСѓЫЎЦЋЩйЃЌБъзМШмвКЕФХЈЖШЦЋИпЃЌЕЮЖЈЪБЯћКФЕФБъзМШмвКЬхЛ§ЦЋЩйЃЌЛсЪЙВтЕУЕФВнЫсШмвКХЈЖШЦЋЕЭЃЛЂђ. ЂйгЩгкaЕуЖдгІЕФЦфЫќЬѕМўЖМЯрЭЌЃЌжЛгаЮТЖШВЛЭЌЃЌвђДЫБэжаa ЖдгІЕФЪЕбщФПЕФЪЧЬНОПЮТЖШВЛЭЌЖдЗДгІЫйТЪЕФгАЯьЃЛЂкМзЭЌбЇИФНјЕФЪЕбщЗНАИЪЧЦфЫќЬѕМўЯрЭЌЪБЃЌРћгУЕШСПЧвЩйСПЕФИпУЬЫсМигыЕШЬхЛ§ВЛЭЌХЈЖШЕФзуСПВнЫсШмвКЗДгІЃЌВтСПШмвКЭЪЩЋЪБМфЁЃШмвКЭЪЩЋЪБМфдНЖЬЃЌдђЗДгІЫйТЪдНПьЁЃ
mol/L=5ЁС10-5mol/LЃЌЖўепЛьКЯКѓЃЌИЦРызгХЈЖШ=2.5ЁС10-5mol/LЃЌВнЫсМиЕФХЈЖШЮЊ4.0ЁС10-4 mol/LЃЌЛьКЯКѓc(Ca2+)c(C2O42-)=2.5ЁС10-5 ЁС4.0ЁС10-4=1ЁС10-8ЃМKspЃЈ4.0ЁС10-8ЃЉЃЌЙЪВЛФмВњЩњГСЕэЃЛЂё. ЂйИпУЬЫсМиШмвКГЃгУЯЁСђЫсЫсЛЏЃЌВнЫсЃЈH2C2O4ЃЉШмвКгыЫсадKMnO4ШмвКЗЂЩњбѕЛЏЛЙдЗДгІЃЌВнЫсБЛбѕЛЏЮЊЖўбѕЛЏЬМЃЌИпУЬЫсМиБЛЛЙдЮЊMn2+ ЃЌРызгЗНГЬЪНЮЊЃК6H++2MnO4-+5H2C2O4 = 10CO2Ёќ+2Mn2++8H2OЃЛЂкЫсадИпУЬЫсМибѕЛЏадЧПЃЌЫљвддкИУЪЕбщжабЁдёЫсЪНЕЮЖЈЙмЃЌЕЮЖЈЪБгУзѓЪжЕФДѓФДжИЁЂЪГжИЁЂжажИа§зЊЕЮЖЈЙмЕФа§ШћЃЌЫљвдД№АИбЁAЃЛЂлХаЖЯЕЮЖЈжеЕуЕФЗНЗЈЪЧЃКЕБЕЮШызюКѓвЛЕЮЫсадИпУЬЫсМиШмвКЃЌШмвКЧЁКУгЩЮоЩЋБфЮЊзЯКьЩЋЧвАыЗжжгФкВЛБфЩЋЃЛЂмШєХфжЦЫсадKMnO4БъзМШмвКЪБЃЌИЉЪгШнСПЦПЕФПЬЖШЯпЃЌдђЫљМгеєСѓЫЎЦЋЩйЃЌБъзМШмвКЕФХЈЖШЦЋИпЃЌЕЮЖЈЪБЯћКФЕФБъзМШмвКЬхЛ§ЦЋЩйЃЌЛсЪЙВтЕУЕФВнЫсШмвКХЈЖШЦЋЕЭЃЛЂђ. ЂйгЩгкaЕуЖдгІЕФЦфЫќЬѕМўЖМЯрЭЌЃЌжЛгаЮТЖШВЛЭЌЃЌвђДЫБэжаa ЖдгІЕФЪЕбщФПЕФЪЧЬНОПЮТЖШВЛЭЌЖдЗДгІЫйТЪЕФгАЯьЃЛЂкМзЭЌбЇИФНјЕФЪЕбщЗНАИЪЧЦфЫќЬѕМўЯрЭЌЪБЃЌРћгУЕШСПЧвЩйСПЕФИпУЬЫсМигыЕШЬхЛ§ВЛЭЌХЈЖШЕФзуСПВнЫсШмвКЗДгІЃЌВтСПШмвКЭЪЩЋЪБМфЁЃШмвКЭЪЩЋЪБМфдНЖЬЃЌдђЗДгІЫйТЪдНПьЁЃ

 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИ

