题目内容
【题目】合成氨是人类科学技术上的一项重大突破,反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:

(1)①步骤Ⅱ中制氢气的原理如下:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1
CO(g)+3H2(g);K1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2
CO2(g)+H2(g);K2
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
②T1温度时,对于反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
A.CO的转化率将增大 B.达到新平衡时的反应热ΔH > —Q
C.气体的密度将不变 D.H2O的体积分数增大
(2)将3 molH2和2 molN2充入某恒温恒压容器中,发生合成氨的反应:3H2(g) +N2(g) ![]() 2NH3(g)
2NH3(g)
①达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
A.6 molH2 + 4 molN2
B.0.75 molH2 + 0.75 molN2 + 0.5 molNH3
C.3 molH2+ 1 molN2 + 2 mol NH3
② 若是在恒温恒容的容器中反应,达到平衡时NH3的浓度为c1 mol·L-1,则c________c1(填“<”“>”或“=”),原因是________________________________________。
【答案】K1·K2 AD C > 在恒容的容器中,随着反应的进行压强会减小,导致反应正向进行的限度减小,所以NH3的浓度会比在恒压容器中的小
【解析】
(1) ①分析写出平衡常数K1和K2、K的表达式,再进行相关运算即可得出答案。②对于反应CO(g)+ H2O(g)![]() CO2(g)+ H2(g)达到平衡后,再通入0.2molH2O(g),即增加反应浓度,平衡向正反应方向移动,据此分析。
CO2(g)+ H2(g)达到平衡后,再通入0.2molH2O(g),即增加反应浓度,平衡向正反应方向移动,据此分析。
(2)①合成氨反应3H2(g)+N2(g)![]() 2NH3(g),题设投料3mol H2和2 mol N2,以此为参照,按等效平衡的思想分析解答。②合成氨反应3H2(g)+N2(g)
2NH3(g),题设投料3mol H2和2 mol N2,以此为参照,按等效平衡的思想分析解答。②合成氨反应3H2(g)+N2(g)![]() 2NH3(g),正反应气体分子数目减小,在恒温恒容条件下达到平衡时的压强小于恒温恒压条件下达到平衡时的压强,所以恒温恒容条件相当于减压过程,由此分析。
2NH3(g),正反应气体分子数目减小,在恒温恒容条件下达到平衡时的压强小于恒温恒压条件下达到平衡时的压强,所以恒温恒容条件相当于减压过程,由此分析。
(1)对于反应CH4(g)+H2O(g)![]() CO(g)+3H2(g),有平衡常数K1=
CO(g)+3H2(g),有平衡常数K1=![]() ,对于反应CO(g)+H2O(g)
,对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g),有平衡常数K2=
CO2(g)+H2(g),有平衡常数K2=![]() ,对于反应CH4(g)+2H2O(g)
,对于反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),有平衡常数K=
CO2(g)+4H2(g),有平衡常数K=![]() ,显然K=K1·K2。
,显然K=K1·K2。
②A.对于反应CO(g)+ H2O(g)![]() CO2(g)+ H2(g)达到平衡后,再通入0.2molH2O(g),平衡向正反应方向移动,CO的转化率增大,A项正确;B.因为平衡向正反应方向移动,放出的热量比Q多,放热反应的ΔH为负,所以达到新平衡时的反应热ΔH<-Q,B项错误;C.因为再通入0.20molH2O(g)时,容器中气体总质量增大,而气体处于恒容容器中,所以气体密度(
CO2(g)+ H2(g)达到平衡后,再通入0.2molH2O(g),平衡向正反应方向移动,CO的转化率增大,A项正确;B.因为平衡向正反应方向移动,放出的热量比Q多,放热反应的ΔH为负,所以达到新平衡时的反应热ΔH<-Q,B项错误;C.因为再通入0.20molH2O(g)时,容器中气体总质量增大,而气体处于恒容容器中,所以气体密度(![]() )将增大,C项错误;D.可逆反应不能进行到底,再通入0.20molH2O(g)时,平衡向正反应方向移动消耗H2O(g)的量小于0.20mol,所以达到新平衡时H2O(g)体积分数将增大,D项正确;答案选AD。
)将增大,C项错误;D.可逆反应不能进行到底,再通入0.20molH2O(g)时,平衡向正反应方向移动消耗H2O(g)的量小于0.20mol,所以达到新平衡时H2O(g)体积分数将增大,D项正确;答案选AD。
(2)①A.6molH2和4molN2与题设初始投入3molH2和2molN2,对应成比例,在恒温恒压条件下分别达到的平衡互为等效平衡,所以A选项平衡后NH3的浓度仍为cmol/L,A项错误;B.将0.75 mol H2、0.75 mol N2和0.5 mol NH3按计量数折算成反应物为1.5molH2和1molN2,这与题设3molH2和2molN2对应成比例,在恒温恒压条件下分别达到的平衡互为等效平衡,所以B选项平衡后NH3的浓度仍为cmol/L,B项错误;C.3 mol H2、1 mol N2和2 mol NH3折算成反应物为6molH2和2molN2,可看作先投入3molH2和2molN2达到平衡后再投入3molH2,相当于在题设的平衡状态下再投入3molH2,显然再投入H2时平衡向正反应方向移动,NH3的浓度将大于c mol/L,C项正确;答案选C。
②合成氨的反应3H2(g)+N2(g)![]() 2NH3(g),正反应气体分子数减小,如果在恒容条件下,达到平衡时的压强比初始压强小,而恒压条件的平衡压强等于初始压强,两种情况下初始压强是相同的,所以恒容条件下相当于减压过程,减压下该反应的平衡向逆反应方向移动,所以恒容条件下NH3的浓度将减小,即c>c1。
2NH3(g),正反应气体分子数减小,如果在恒容条件下,达到平衡时的压强比初始压强小,而恒压条件的平衡压强等于初始压强,两种情况下初始压强是相同的,所以恒容条件下相当于减压过程,减压下该反应的平衡向逆反应方向移动,所以恒容条件下NH3的浓度将减小,即c>c1。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
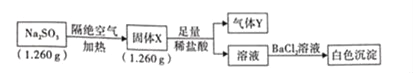
优百分课时互动系列答案【题目】常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
温度/℃ | c(NH3·H2O) /(mol·L-1) | 电离常数 | 电离度/% | c(OH-) /(mol·L-1) |
0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
提示:![]()
(1)温度升高,NH3·H2O的电离平衡向________(填“左”或“右”)移动,能支持该结论的表中数据是________(填字母)。
a.电离常数 b.电离度 c.c(OH-) d.c(NH3·H2O)
(2)表中c(OH-)基本不变的原因是__________________________________。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是_______(填字母,下同)。
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(4)氨水溶液中,下列做法能使c(NH4+)与c(OH-)比值变大的是________。
A.加入固体氯化铵 B.通入少量氯化氢
C.降低溶液温度 D.加入少量固体氢氧化钠
【题目】25℃下,部分弱酸的电离常数如表。下列有关说法不正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c(HCOOH)/c(HCOO-)=10
B. 相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大
C. 任何浓度NaHS溶液中总存在:c(H2S)+c(H+)=c(OH-)+c(S2-)
D. 向 NaClO溶液中通入H2S发生的反应为2C1O-+H2S===S2-+2HClO
【题目】目前,燃煤脱硫是科研工作者研究的重要课题之一,主要脱硫方法有以下几种:
Ⅰ.石灰法原理为:2CaO(s)+2SO2(g)+O2(g)2CaSO4(s)
(1)T1℃时,向10L恒容密闭容器中加入3molCaO(s),并通入2molSO2(g)和1molO2(g)发生上述反应,2min时达平衡,此时CaSO4(s)为1.8mol。0~2min内,用SO2(g)表示的该反应的速率v(SO2)=__________________________。
Ⅱ.催化氧化法
活性炭催化氧化法是基于活性良好的物理吸附和化学吸附作用,其反应机理为:
O2+2C→2C—O;SO2+C→C—SO2;C—SO2+C—O→C—SO3+C;
C—SO3+H2O→C—H2SO4;C—H2SO4→H2SO4+C。
(2)整个过程中总的化学反应方程式为__________________________________________。
(3)活性炭在反应过程中作催化剂,改变了_____________(填选项字母)。
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能
Ⅲ.CO还原法原理为2CO(g)+SO2(g)S(g)+2CO2(g) ΔH
已知:S(g)+O2(g)=SO2(g) ΔH1=-574.0kJ·mol-1;CO燃烧热为283.0kJ·mol-1。
(4)起始温度为T2℃时,分别在三个容积均为10L的绝热密闭容器中,发生反应2CO(g)+SO2(g)S(g)+2CO2(g),测得相关数据如下表所示。
容器 | 起始时物质的量/mol | 平衡时CO2(g)的物质的量/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 0 | A |
乙 | 1 | 0.5 | 0 | 0 | 0.8 |
丙 | 2 | 1 | 0 | 0 | b |
①容器乙达到平衡后,保持其他条件不变,再向其中充入CO(g)、 SO2(g)、S(g)、CO2(g)各1mol,此时v(正)__________ v(逆)。(填“>”、“<”或“=”)。
②下列判断正确的是________________(填选项字母)。
A.b=1.6 B.平衡常数甲>乙 C.达到平衡的时间:丙<乙