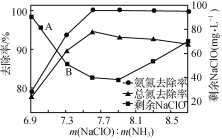
题目内容
【题目】如图所示,甲、乙、丙、丁四个烧杯中分别盛有100mL蒸馏水,然后分别放入等物质的量的Na、Na2O、Na2O2、NaOH,待固体完全溶解,则四个烧杯中溶液的质量分数的大小顺序为( )
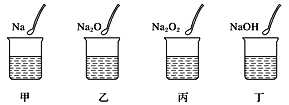
A.甲<乙<丙<丁B.丁<甲<乙=丙C.甲=丁<乙=丙D.丁<甲<乙<丙
【答案】B
【解析】
设钠、氧化钠、过氧化钠和氢氧化钠的物质的量均为0.1mol:
Na+H2O=NaOH+![]() H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+![]() O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g;
O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g;
氢氧化钠溶于水,与水不反应,溶液增加的质量=m(NaOH)=4.0g;
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,0.1mol;
通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、氢氧化钠分别溶于水所得氢氧化钠溶液的质量分数分别为:![]() ×100%、
×100%、![]() ×100%、
×100%、![]() ×100%、
×100%、![]() ×100%,所以甲、乙、丙、丁的质量分数大小的顺序是:丁<甲<乙=丙,故选B。
×100%,所以甲、乙、丙、丁的质量分数大小的顺序是:丁<甲<乙=丙,故选B。

练习册系列答案
相关题目