题目内容
【题目】已知固体Na2SO3受热分解生成两种正盐,实验流程和结果如下:
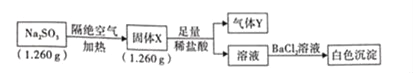
已知:气体Y是一种纯净物,在标准状况下密度为1.518gL﹣1.请回答下列问题:
(1)气体Y的电子式为_____。
(2)实验流程中,Na2SO3受热分解的化学方程式为_____。
(3)另取固体X试样和Na2SO3混合,加适量蒸馏水溶解,再加入稀盐酸,立即有淡黄色沉淀产生。则产生淡黄色沉淀的离子方程式为_____(不考虑空气的影响)。
(4)Na2SO3长期露置在空气中,会被氧化成Na2SO4,检验Na2SO3是否变质的实验操作是_____。
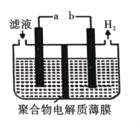
(5)某研究性学习小组通过图所示装置,利用电化学方法处理上述流程中产生的气体Y.基本工艺是将气体Y通入FeCl3,待充分反应后过滤,将所得滤液加入电解槽中进行电解,电解后的滤液可以循环利用。则与a相连的电极反应式为_____。
【答案】![]() 4Na2SO3
4Na2SO3![]() Na2S+3Na2SO4 2S2﹣+SO32﹣+6H+=3S↓+3H2O 取少量亚硫酸钠样品于一支试管中,加入适量蒸馏水溶解,向溶液中加入足量盐酸后,再滴入几滴氯化钡溶液,若生成白色沉淀说明有Na2SO3被氧化为Na2SO4 Fe2+﹣e﹣=Fe3+ 。
Na2S+3Na2SO4 2S2﹣+SO32﹣+6H+=3S↓+3H2O 取少量亚硫酸钠样品于一支试管中,加入适量蒸馏水溶解,向溶液中加入足量盐酸后,再滴入几滴氯化钡溶液,若生成白色沉淀说明有Na2SO3被氧化为Na2SO4 Fe2+﹣e﹣=Fe3+ 。
【解析】
(1)气体Y是一种纯净物,标准状况下密度为1.518g·L-1,则Y的摩尔质量为1.518g·L-1×22.4L·mol-1=34g·mol-1,根据元素守恒,推出Y为H2S,电子式为![]() ;
;
(2)由以上分析可知,气体Y为H2S,以及生成气体Y的条件,推出固体X中含有S2-,即固体X中含有Na2S,溶液中加入BaCl2溶液,出现白色沉淀,该白色沉淀为BaSO4,则固体X中含有Na2SO4,Na2SO3受热分解生成Na2S和Na2SO4,反应的化学方程式为4Na2SO3![]() Na2S+3Na2SO4;
Na2S+3Na2SO4;
(3)固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,即有S单质生成,反应的离子方程式为2S2﹣+SO32﹣+6H+=3S↓+3H2O;
(4)Na2SO3长期露置在空气中,会被氧化成Na2SO4,检验Na2SO3是否变质的实验操作是:取少量亚硫酸钠样品于一支试管中,加入适量蒸馏水溶解,向溶液中加入足量盐酸后,再滴入几滴氯化钡溶液,若生成白色沉淀说明有Na2SO3被氧化为Na2SO4,亚硫酸钠变质;
(5)将气体Y通入FeCl3,发生氧化还原反应吸收二氧化硫,装置图中放出氢气的一端为阴极,b为电源负极,a为电源正极,将所得滤液加入电解槽中进行电解,电解后的滤液可以循环利用,说明亚铁离子在阳极失电子生成了铁离子,电极反应为:Fe2+﹣e﹣=Fe3+。

 阅读快车系列答案
阅读快车系列答案【题目】草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和用于制药工业。某化学兴趣小组对其性质进行如下探究,回答下列问题:
I.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4溶液、K3[Fe(CN)6]溶液
操作 | 现象 | 结论与解释 |
(1)取少量草酸亚铁晶体于试管中,加入2mL水,振荡后静置 | 有淡黄色沉淀,上层清液无色 | 草酸亚铁不溶于水 |
(2)继续加入2mL稀硫酸,振荡 | ___________ | 草酸亚铁溶于硫酸,硫酸酸性强于草酸 |
(3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | ___________ |
(4)①___________ | ②___________ | H2C2O4或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x的值
(5)滴定前,下列操作的正确顺序是___________(填字母序号)。
a.用0.1000mol/L的酸性KMnO4溶液润洗
b.查漏、清洗
c.排尽滴定管尖嘴的气泡并调整液面
d.盛装0.1000mol/L的酸性KMnO4溶液
e.初始读数、记录为0.50mL
(6)称取ng样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4溶液直接滴定,如何判断滴定终点?_______________。
(7)终点读数为20.50mL。结合上述实验数据求得x=___________(用含n的代数式表示,FeC2O4的相对分子质量为144)。