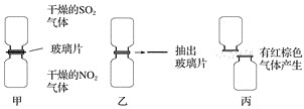
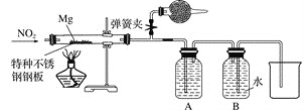
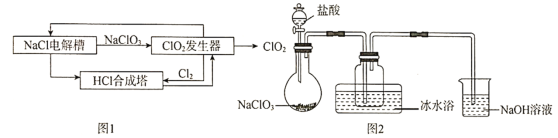
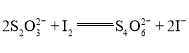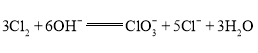题目内容
【题目】某化学小组探究在其他条件不变时,改变某一条件对某类反应aA(g)+bB(g)![]() cC(g)的 化学平衡的影响,得到如图图像(图中p表示压强,T表示温度,n 表示物质的量,α表示转 化率)。下列说法正确的是( )
cC(g)的 化学平衡的影响,得到如图图像(图中p表示压强,T表示温度,n 表示物质的量,α表示转 化率)。下列说法正确的是( )

A.反应Ⅰ的正反应ΔH>0B.若p1>p2,则a+b<c
C.反应Ⅱ的逆反应ΔH>0D.反应Ⅱ中T1>T2
【答案】C
【解析】
A.根据反应Ⅰ的图像,P1时,升高温度,A的转化率降低,平衡逆向移动,则正反应为放热反应,正反应ΔH<0,A错误;
B.若p1>p2,向T轴作垂线,为等温线,温度相等,增大压强,则A的转化率升高,平衡正向移动,则a+b>c,B错误;
C.根据反应Ⅱ的图像,温度越高,反应时间越短,则T2>T1,升高温度C的物质的量减小,平衡逆向移动,则逆反应ΔH>0,C正确;
D.温度越高,反应时间越短,反应Ⅱ中T1<T2,D错误;
答案为C。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
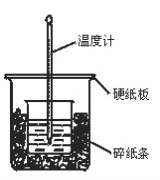
(1)从实验装置图看,尚缺少的一种玻璃仪器是________。
(2)烧杯间填充碎纸条的作用是_________。
(3)按如图装置进行实验,测得中和热的数值_______(填“偏大”“偏小”或“无影响”)其原因是_____。
(4)若实验中改用80 mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_____(填“相等、“不相等”)。
(5)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.5 |
依据该学生测得的实验数据进行计算,中和热ΔH=______(结果保留一位小数)。
(6)能否用稀Ba(OH)2溶液和稀硫酸代替氢氧化钠溶液和盐酸反应测定中和热_______(填“能”或“否”)。