题目内容
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
表1.几种砷酸盐的Ksp
表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=______________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=______________,若混合溶液
中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是_______________mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式________________________________。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH
调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为______________;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_____________________________。
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42 g/L | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=______________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=______________,若混合溶液
中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是_______________mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式________________________________。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH
调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为______________;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为_____________________________。
12分)⑴0.29
⑵c3 (Ca2+)·c2 (AsO43-) 5.7×10-17
⑶2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O
⑷①CaSO4
②H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀
(每空2分,共12分)
⑵c3 (Ca2+)·c2 (AsO43-) 5.7×10-17
⑶2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O
⑷①CaSO4
②H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀
(每空2分,共12分)
(1)图表中硫酸浓度为28.42g/L,换算物质的量浓度=
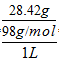 =0.29mol/L
=0.29mol/L(2)难溶物Ca3(AsO4)2的沉淀溶解平衡为:Ca3(AsO4)2(s)?3Ca2++2AsO43-;溶度积Ksp=c3(Ca2+)?c2 (AsO43-);若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol?L-1,依据Ksp大小可以得到,Ksp(FeAsO4 )小,反应过程中Fe3+先析出沉淀;依据Ksp(FeAsO4 )=c(Fe3+)c(AsO43-)=5.7×10-21;Fe3+的浓度均为1.0×10-4mol?L-1,计算得到 c(AsO43-)=5.7×10-17mol/L;
答案为:c3(Ca2+)?c2 (AsO43-);5.7×10-17;
⑶离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O
⑷①CaO+H2SO4=CaSO4+H2O,CaSO4是微溶,饱和而析出,答案:CaSO4
②H3AsO4是弱酸,酸性条件下以主要以分子形式存在,随pH增大,AsO43-浓度增大,当溶液中pH调节到8左右时AsO43-浓度增大到Ca3(AsO4)2的浓度熵大于Ca3(AsO4)2的 Ksp Ca3(AsO4)2开始沉淀;
答案:H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

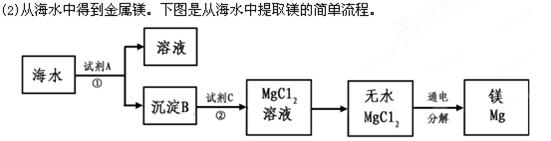 上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________,
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为__________, 上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。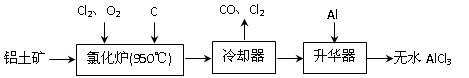
 的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。 研究的一项重要任务。
研究的一项重要任务。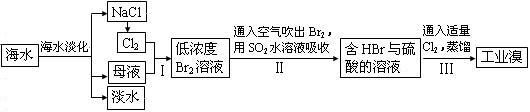
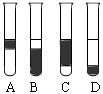 ②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为右图中 ▲ 。
②在3mL溴水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象为右图中 ▲ 。
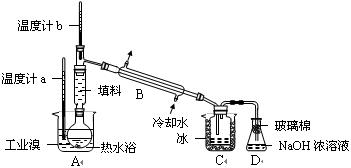
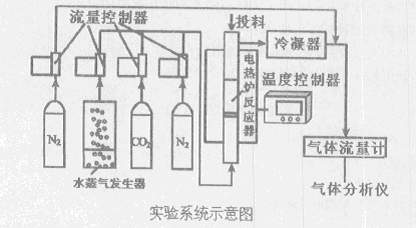
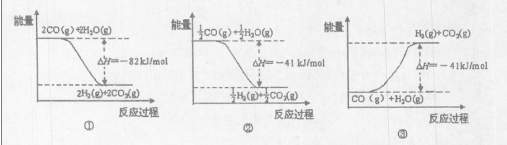
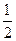 O2(g)=CO2(g) △H=-283kJ/mol
O2(g)=CO2(g) △H=-283kJ/mol H2(g)+CO2(g)
H2(g)+CO2(g)