(12分)
某炼铁废渣中含有大量CuS及少量铁的化合物(铁元素的化合价为+2和+3价),工业上以该废渣为原料生产CuCl2的工艺流程如下:
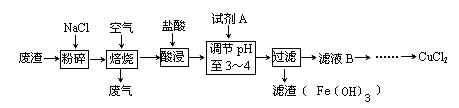
焙烧过程中发生的主要反应为:CuS+2NaCl+2O2高温CuCl2+Na2SO4。
回答下列问题:
(1)焙烧前先进行粉碎的理由是_____________________________________________。
(2)试剂A应选用 (填编号)①NaClO、②Cl2、③H2O2溶液、④浓硫酸
加入试剂A的目的是____________________________________________________________。
(3)上述过滤操作中需要用到的玻璃仪器有_____________________________________________。
(4)从CuCl2溶液得到CuCl2晶体的操作是 (写出操作名称),该操作必需在HCl气流中进行,原因是_____________________________________________(用离子方程式表示)。
(5)如何检验滤液B中是否还有未沉淀的Fe3+______________________________,
加试剂A调节溶液pH=4时,c(Fe3+)为_______________。(已知Ksp[Fe(OH)3]=2.6×10-39)

