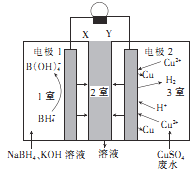
题目内容
【题目】为探究某黄色固体的组成和性质,设计如下实验:

请回答:
(1)X 的化学式是_______。
(2)X 在空气中充分灼烧的化学方程式为_______。
(3)溶液 A 与烧碱反应生成 B 和浅黄色沉淀(0.01mol)的化学方程式为_______。
【答案】CuFeS2 4CuFeS2+13O2=4CuO+2Fe2O3+8SO2 3Fe2 (SO4)3+12NaOH=Na2Fe6 (SO4)4 (OH)12+5Na2SO4
【解析】
根据流程图,11.04gX在空气中灼烧,生成的气体使品红溶液褪色的气体是二氧化硫,生成的黑色固体氧化物应该为CuO,得到红褐色固体氧化物应该为 Fe2O3,根据图示中提供的数据计算含有S、Cu、Fe元素的物质的量确定X的化学式以及物质的量;氧化铁加入适量稀硫酸溶解得到含一种溶质的溶液为Fe2(SO4)3溶液,再加入NaOH反应生成溶液为7.1g,单一溶质且只含一种金属元素,B为Na2SO4,结合元素守恒和电荷守恒分析判断黄色沉淀所含成分,据此分析解答。
根据流程图,11.04gX在空气中灼烧,生成的气体使品红溶液褪色的气体是二氧化硫,n(SO2)=![]() =0.12mol,生成的黑色固体氧化物应该为CuO,物质的量n(CuO)=
=0.12mol,生成的黑色固体氧化物应该为CuO,物质的量n(CuO)=![]() =0.06mol,得到红褐色固体氧化物应该为 Fe2O3,物质的量n(Fe2O3)=
=0.06mol,得到红褐色固体氧化物应该为 Fe2O3,物质的量n(Fe2O3)=![]() =0.03mol,则化合物中含Fe、Cu、S,物质的量之比n(Fe) ∶n(Cu)) ∶n(S)=0.03×2∶0.06∶0.12=1∶1∶2,因此X化学式为FeCuS2,物质的量0.06mol,质量=0.06mol×(56+64+64)g/mol=11.04g,符合题意,上述推断正确,氧化铁加入适量稀硫酸溶解得到含一种溶质的溶液为Fe2(SO4)3溶液,则n[Fe2(SO4)3]=0.03mol,4.8gNaOH反应生成溶液为7.1g,单一溶质且只含一种金属元素,推断为Na2SO4,n(NaOH)=
=0.03mol,则化合物中含Fe、Cu、S,物质的量之比n(Fe) ∶n(Cu)) ∶n(S)=0.03×2∶0.06∶0.12=1∶1∶2,因此X化学式为FeCuS2,物质的量0.06mol,质量=0.06mol×(56+64+64)g/mol=11.04g,符合题意,上述推断正确,氧化铁加入适量稀硫酸溶解得到含一种溶质的溶液为Fe2(SO4)3溶液,则n[Fe2(SO4)3]=0.03mol,4.8gNaOH反应生成溶液为7.1g,单一溶质且只含一种金属元素,推断为Na2SO4,n(NaOH)=![]() =0.12mol,n(Na2SO4)=
=0.12mol,n(Na2SO4)=![]() =0.05mol,结合元素守恒和电荷守恒,0.03molFe2(SO4)3和0.12molNaOH反应得到0.05molNa2SO4和浅黄色沉淀,浅黄色沉淀中含n(Na+)=0.12mol-0.05mol×2=0.02mol,n(Fe3+)=0.06mol,n(OH-)=0.12mol,n(SO42-)=0.03mol×3-0.05mol=0.04mol,得到浅黄色沉淀组成:n(Na+)∶n(Fe3+)∶n(OH-)∶n(SO42-)=0.02∶0.06∶0.12∶0.04=1∶3∶6∶2,组成为NaFe3 (SO4)2(OH)6。
=0.05mol,结合元素守恒和电荷守恒,0.03molFe2(SO4)3和0.12molNaOH反应得到0.05molNa2SO4和浅黄色沉淀,浅黄色沉淀中含n(Na+)=0.12mol-0.05mol×2=0.02mol,n(Fe3+)=0.06mol,n(OH-)=0.12mol,n(SO42-)=0.03mol×3-0.05mol=0.04mol,得到浅黄色沉淀组成:n(Na+)∶n(Fe3+)∶n(OH-)∶n(SO42-)=0.02∶0.06∶0.12∶0.04=1∶3∶6∶2,组成为NaFe3 (SO4)2(OH)6。
(1)根据上述计算可知X为FeCuS2,故答案为:FeCuS2;
(2X在空气中充分灼烧生成二氧化硫、氧化铁、氧化铜,结合电子守恒和原子守恒书写得到反应的化学方程式为:4FeCuS2+13O2![]() 4CuO+2Fe2O3+8SO2,故答案为:4FeCuS2+13O2
4CuO+2Fe2O3+8SO2,故答案为:4FeCuS2+13O2 ![]() 4CuO+2Fe2O3+8SO2;
4CuO+2Fe2O3+8SO2;
(3)溶液A与烧碱反应生成B和浅黄色沉淀(0.01mol)的反应是氢氧化钠和硫酸铁反应生成硫酸钠和浅黄色沉淀,结合上述计算得到沉淀化学式为Na2Fe6 (SO4)4 (OH)12,反应的化学方程式为:3Fe2(SO4)3+12NaOH=5Na2SO4+ Na2Fe6 (SO4)4 (OH)12↓,故答案为:3Fe2(SO4)3+12NaOH=5Na2SO4+ Na2Fe6 (SO4)4 (OH)12↓。