题目内容
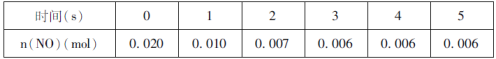
【题目】电Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(OH)能氧化降解有机污染物。下列说法错误的是
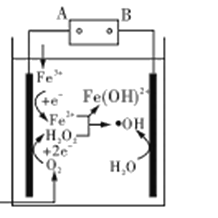
A.电源的A极为负极
B.每消耗2. 24 LO2(标准状况),整个电解池中理论上可产生的OH为0.2 mol
C.与电源B极相连电极的电极反应式为:H2O-e-=H++﹒OH
D.H2O2与Fe2+发生的反应方程式为:H2O2+Fe2+=Fe(OH)2++﹒OH
【答案】B
【解析】
由反应原理图可知,Fe3+在左端电极得电子生成Fe2+,发生还原反应,左端电极为阴极,则A为电源的负极,B为电源的正极。
A.由以上分析知,A极为电源的负极,A正确;
B.每消耗0.1molO2,在阴极共得到0.3mole-,生成0.1molOH,同时阳极失去0.3mole-,生成0.3molOH,所以共生成OH为0.4 mol,B不正确;
C.与电源B极相连的电极为阳极,水在阳极上失电子生成OH,电极反应式为:H2O-e-=H++OH,C正确;
D.电解产生的H2O2与Fe2+发生反应,生成OH和Fe(OH)2+,反应方程式为:H2O2+Fe2+=Fe(OH)2++OH,D正确;
故选B。

练习册系列答案
相关题目