题目内容
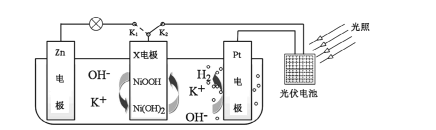
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是
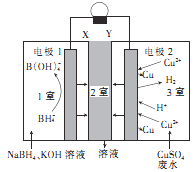
A.电极1为负极
B.Y为阳离子选择性交换膜
C.电极2上只有Cu析出
D.负极的电极反应式: ![]() +8
+8![]() 8
8![]() B
B![]() +4
+4![]()
【答案】BC
【解析】
由图中可知,1室中B![]() 转变为B
转变为B![]() 化合价身高发生氧化反应,则电极1为负极,电极方程式为:
化合价身高发生氧化反应,则电极1为负极,电极方程式为:![]() ,为了平衡电荷阳离子流入2室;3室中Cu2+及H+在正极上得到电子被还原,故电极2为正极,电极方程式为:
,为了平衡电荷阳离子流入2室;3室中Cu2+及H+在正极上得到电子被还原,故电极2为正极,电极方程式为:![]() ,
,![]() ,阳离子被消耗,为了平衡电荷阴离子流入2室,以此分析。
,阳离子被消耗,为了平衡电荷阴离子流入2室,以此分析。
由图中可知,1室中B![]() 转变为B
转变为B![]() 化合价身高发生氧化反应,则电极1为负极,电极方程式为:
化合价身高发生氧化反应,则电极1为负极,电极方程式为:![]() ,为了平衡电荷阳离子流入2室;3室中Cu2+及H+在正极上得到电子被还原,故电极2为正极,电极方程式为:
,为了平衡电荷阳离子流入2室;3室中Cu2+及H+在正极上得到电子被还原,故电极2为正极,电极方程式为:![]() ,
,![]() ,阳离子被消耗,为了平衡电荷阴离子流入2室,故X为阳离子交换膜,Y为阴离子交换膜。
,阳离子被消耗,为了平衡电荷阴离子流入2室,故X为阳离子交换膜,Y为阴离子交换膜。
A.电极1为负极,故A正确;
B. Y为阴离子选择性交换膜,故B错误;
C. 电极2上只有Cu、H2析出,故C错误;
D.负极的电极反应式:![]() ,故D正确;
,故D正确;
故答案选:BC。

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目