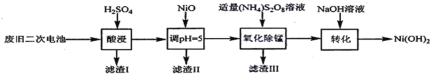
题目内容
【题目】常温下,往 H3PO4 溶液中滴加 NaOH 溶液,体系中含磷各物种所占的物质的量分数 (α)随溶液pH 变化的关系如图所示。下列有关说法不正确的是

A.为尽可能得到较纯的 NaH2PO4,pH 应控制在 4~5.5 左右
B.在 pH<7.2 的溶液中,c (H2PO4 - )>c (HPO42 -)
C.当 pH=7.2 时,H2PO4 - 与 HPO42 -的物质的量相等且等于原溶液磷酸物质的量的一半
D.pH=13 时,溶液中各微粒浓度大小关系为:c (Na+)>c (PO43-)>c (HPO42-)>c (OH-)>c (H+)
【答案】C
【解析】
由图象可知横坐标每一小格代表0.5个pH单位。
A.由图象可知,要获得尽可能纯的NaH2PO4,pH应控制在4~5.5之间,故A正确;
B.由图象可知,当 pH=7.2 时,c (H2PO4 - )=c (HPO42 -),则在 pH<7.2 的溶液中,c (H2PO4 - )>c (HPO42 -),故B正确;
C.由图象可知,当 pH=7.2 时,c (H2PO4 - )=c (HPO42 -),则H2PO4 - 与 HPO42 -的物质的量相等,溶液中还含有少量的H3PO4和PO43-,根据P原子守恒,都小于原溶液磷酸物质的量的一半,故C错误;
D.由图象可知,pH=12.2时,c(HPO42-)=c(PO43-),在pH=13时,c (PO43-)>c (HPO42-),溶液中主要含有Na2HPO4和Na3PO4,溶液显碱性,则c (Na+)>c (PO43-)>c (HPO42-)>c (OH-)>c (H+),故D正确;
故选C。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目