题目内容
6.下列叙述正确的是( )| A. | 固体时能导电的晶体一定为金属晶体 | |
| B. | 某晶体固态不导电,水溶液能导电,该晶体一定为离子晶体 | |
| C. | 某晶体难溶于水、熔点高、固态不导电,熔化时导电,可判断该晶体为离子晶体 | |
| D. | 由原子构成的晶体均具有熔沸点高、硬度大的特性 |
分析 A.含有自由离子或电子的物质能导电,能导电的固体不一定是金属单质;
B.固态不导电、其水溶液导电的晶体可能是分子晶体;
C.离子化合物的构成微粒为离子,其熔融状态下能导电,熔点高、固态不导电;
D.由原子构成的晶体可能为原子晶体、分子晶体,原子晶体具有熔沸点高、硬度大的特性,分子晶体不是.
解答 解:A.能导电的固体不一定是金属单质,如石墨,故A错误;
B.固态不导电、其水溶液导电的晶体可能是分子晶体,如冰醋酸,故B错误;
C.晶体难溶于水、熔点高,固态时不导电,熔化时能导电,说明熔化时有自由移动的离子,属于离子晶体,故C正确;
D.由原子间通过共价键而形成的原子晶体,具有高熔、沸点及硬度的特点,如金刚石,由原子构成的分子晶体,如稀有气体不具有熔沸点高、硬度大的特性,故D错误;
故选C.
点评 本题考查晶体的类型及性质,注意离子化合物的构成微粒为离子,明确熔融态能导电是解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.以下物质间的每步转化都可以通过一步反应能实现的是( )
| A. | Al→Al2O3→Al(OH)3→Na[Al(OH)4] | B. | Fe→FeO→Fe(OH)2→Fe(OH)3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | Na→Na2O2→Na2CO3→NaOH |
17.根据下列短周期元素性质的数据判断,下列说法正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径∕10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.24 |
| 最高价或最低价 | -2 | +2 | +1 | +5 -3 | +7 -1 | +1 | +5 -3 | +3 |
| A. | 元素④⑤形成的化合物是离子化合物 | |
| B. | 元素⑦位于第二周期第V族 | |
| C. | 元素①⑧形成的化合物具有两性 | |
| D. | 元素③的最高价氧化物对应水化物的碱性最强 |
14.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. | 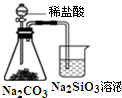 图所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 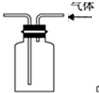 用图所示实验装置排空气法收集CO2气体 | |
| C. | 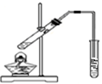 用图装置制备少量乙酸乙酯 | |
| D. | 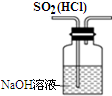 图装置可以用来除去SO2中的HCl |
1.在同一温度下,当弱电解质溶液a,强电解质溶液b,金属导体c的导电能力相同,若同时升高到相同温度,则它们的导电能力是( )
| A. | a>b>c | B. | a=b=c | C. | c>a>b | D. | b>c>a |
11.下列有关金属的说法正确的是( )
| A. | 金属单质在常温下都是固体 | |
| B. | 金属原子只有还原性,金属阳离子只有氧化性 | |
| C. | 含金属元素的离子都是阳离子 | |
| D. | 金属阳离子被还原不一定生成金属单质 |
18.下列原子的电子排布图中,正确的是( )
| A. | 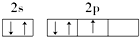 | B. | 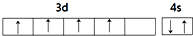 | ||
| C. | 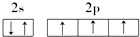 | D. | 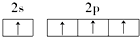 |
15.以下化石能源的加工所得产品不符合事实的是( )
| A. | 石油分馏-乙炔 | B. | 石油裂解-乙烯 | ||
| C. | 煤焦油分馏-苯酚 | D. | 天然气热分解-炭黑 |
16.在容积一定的密闭容器中,发生可逆反应:A(g)+B(g)?xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是( )
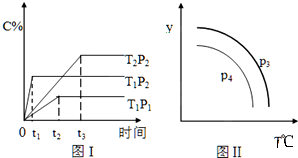

| A. | x=2,T1>T2,P2>P1 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |