题目内容
【题目】(1)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 |
| 142 |
| 2560 | Br- | 64 |
Mg2+ | 1272 |
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴(阳)离子通过。
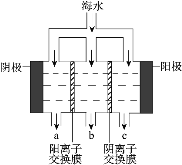
①电解氯化钠溶液的离子方程式_____。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因_____。 在阴极附近产生少量白色沉淀,其成分有_________和CaCO3。
③淡水的出口为_________(填“a”、“b”或“c”);a 出口物质为_____(填化学式)。
④若用下面燃料电池为电源电解 100mL1molL-1 氯化钠溶液,当电池消耗0.00025 molO2 时,常温下,所得溶液的 pH 为__________(忽略反应前后溶液体积变化)
(2)如图Ⅰ是氢氧燃料电池(电解质为 KOH 溶液)的结构示意图,
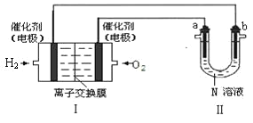
①Ⅰ中通入O2的一端为电池的_____极。 通入H2的一端的电极反应式_________
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是_____,N 溶液为_____溶液。
③若在Ⅱ中实现 Cu+H2SO4= CuSO4+H2↑,则a 极的反应式是_____,N 溶液为 _____溶液。
(3)工业上用 Na2SO3 溶液吸收 SO2,过程中往往得到 Na2SO3 和 NaHSO3的混合溶液,溶液 pH 随 n(![]() ):n(
):n(![]() ) 变化关系如下表:
) 变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图示回答:

①![]() 在阳极放电的电极反应式是_____。
在阳极放电的电极反应式是_____。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:_____。
【答案】2Cl-+ 2H2O![]() 2OH-+H2↑+ Cl2↑ H+得电子生成H2,H+浓度减小,促使水的电离平衡向着电离方向移动,OH-浓度增大 Mg(OH)2 b NaOH 12 正 H2-2e-+2OH-=2H2O 锌 CuSO4 Cu-2e-= Cu2+ 稀H2SO4 H2O+HSO3--2e-= SO42-+3H+ 阴极室H+放电,产生OH-,OH-和HSO3-反应,生成SO32-,Na+通过阳离子交换膜进入阴极室,Na2SO3溶液吸收SO2,又得到Na2SO3和NaHSO3的混合溶液,实现循环利用和再生
2OH-+H2↑+ Cl2↑ H+得电子生成H2,H+浓度减小,促使水的电离平衡向着电离方向移动,OH-浓度增大 Mg(OH)2 b NaOH 12 正 H2-2e-+2OH-=2H2O 锌 CuSO4 Cu-2e-= Cu2+ 稀H2SO4 H2O+HSO3--2e-= SO42-+3H+ 阴极室H+放电,产生OH-,OH-和HSO3-反应,生成SO32-,Na+通过阳离子交换膜进入阴极室,Na2SO3溶液吸收SO2,又得到Na2SO3和NaHSO3的混合溶液,实现循环利用和再生
【解析】
氯化钠溶液中含Na+、Cl-、H+、OH-,根据放电顺序Cl-、H+优先失电子分析产物,书写离子方程式,也因为H+减少会引起水的电离平衡向着电离方向移动,OH-浓度增大,阴极区碱性增强,进而除去Ca2+、Mg2+,则阴极室a出口为NaOH,因电解池中阳离子移向阴极,阴离子移向阳极,则淡水出口为b,原电池电解池组合电路中整个电路中转移的电子数目相同,得出关系式进行计算;组合电路中b与电源负极相连,为阴极,得电子,a与电源正极相连,为阳极,失电子,根据题目给出信息判断得失电子情况,确定其位置进行作答;吸收液再生循环原理根据电解池工作原理,结合图示进行分析。
(1)①氯化钠溶液中含Na+、Cl-、H+、OH-,电解时阳极Cl-失电子生成Cl2,阴极H+得电子生成H2,电解氯化钠溶液的离子方程式为:2Cl-+ 2H2O![]() 2OH-+H2↑+ Cl2↑;
2OH-+H2↑+ Cl2↑;
②由①可知,电解过程中阴极H+得电子生成H2,导致溶液中H+浓度减小,促使水的电离平衡向着电离方向移动,溶液中OH-浓度增大,碱性增强;因为OH-浓度增大,会与Mg2+生成Mg(OH)2白色沉淀,同时还能与HCO3-反应生成CO32-,CO32-与Ca2+生成CaCO3,故阴极附近产生的白色沉淀有Mg(OH)2和CaCO3;
③电解池中,阳离子移向阴极,阴离子移向阳极,则淡水出口为b,Ca2+、Mg2+在阴极生成沉淀被除去,故a出口的物质为NaOH;
④当电池消耗0.00025molO2时,根据得失电子守恒和化学计量数得出关系:
O2~4e-~2H2~4NaOH,则生成n(NaOH)= 0.00025mol×4=0.001mol, c(OH-)= c(NaOH)= 0.001mol/0.1L=0.01 mol/L,常温下c(H+)=KW/ c(OH-)=10-12 mol/L, pH=12;
(2)①氢氧燃料电池,O2得电子,从正极通入,H2失电子,从负极通入,电解质溶液为KOH溶液,故电极反应式为H2-2e-+2OH-=2H2O;
②锌片上镀铜,则锌被保护,为阴极,铜被消耗,为阳极,b与电源负极相连,为阴极,故b的电极材料是锌,Cu2+得电子,N溶液为CuSO4溶液;
③a与电源正极相连,为阳极,Cu+H2SO4= CuSO4+H2↑,Cu失去电子作阳极,电极反应式为:Cu-2e-= Cu2+,N溶液为稀H2SO4;
(3)①由图可知,HSO3-在阳极失电子得到SO42-,故电极反应式为HSO3--2e-= SO42-+H+;
②阴极H+得电子生成H2,OH-浓度增大,Na+通过阳离子交换膜进入阴极室,则阴极室产生的物质为NaOH,NaOH用于吸收SO2,得到Na2SO3和NaHSO3,将混合溶液进行电解,又可以得到NaOH吸收液,实现循环利用和再生。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案