题目内容
【题目】下列化学过程及其表述正确的是( )
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.由水电离的c(H+)为10-3mol/L的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存
C.酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低
D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++ H2O2=2Mn2++5O2↑+8H2O
【答案】C
【解析】
A. 向NaHSO4溶液中滴入Ba(OH)2溶液至中性时,假设NaHSO4溶液中有1molH+,需要加入1molOH-,则需要加入0.5molBa(OH)2。Ba2+和OH-,二者的物质的量的比是2:1,反应的离子方程式应该为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,A错误;
B. 由水电离的c(H+)为10-3mol/L的溶液,溶液显酸性或碱性,酸性条件下,H+、NO3-、SO32-会发生氧化还原反应,不能大量共存,B错误;
C. 盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,会造成标准液体积读数偏小,由c测=![]() 可知,最终使测定结果偏低,C正确;
可知,最终使测定结果偏低,C正确;
D. 浓盐酸具有强的还原性,会被KMnO4溶液氧化,不能证明H2O2具有还原性,D错误;
故合理选项是C。

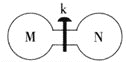
【题目】常温下,向如图所示的两个容积相同的刚性容器中分别充入气体M、N(如表所示),使两容器中压强相等。打开开关k,两容器中的气体充分混合后,恢复至常温,容器内的气体压强(固体影响忽略不计)由大到小的顺序正确的是 ( )
装置 | 编号 |
|
|
|
|
| M | NH3 | HI | NO | H2 |
N | Cl2 | Cl2 | O2 | O2 |
A.①=④>②=③ B.①=④>②>③
C.④>①>②>③D.①>④>②>③
【题目】(1)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 |
| 142 |
| 2560 | Br- | 64 |
Mg2+ | 1272 |
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴(阳)离子通过。
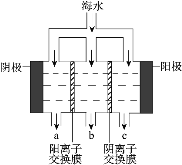
①电解氯化钠溶液的离子方程式_____。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因_____。 在阴极附近产生少量白色沉淀,其成分有_________和CaCO3。
③淡水的出口为_________(填“a”、“b”或“c”);a 出口物质为_____(填化学式)。
④若用下面燃料电池为电源电解 100mL1molL-1 氯化钠溶液,当电池消耗0.00025 molO2 时,常温下,所得溶液的 pH 为__________(忽略反应前后溶液体积变化)
(2)如图Ⅰ是氢氧燃料电池(电解质为 KOH 溶液)的结构示意图,
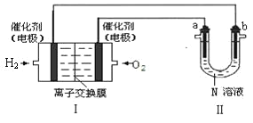
①Ⅰ中通入O2的一端为电池的_____极。 通入H2的一端的电极反应式_________
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是_____,N 溶液为_____溶液。
③若在Ⅱ中实现 Cu+H2SO4= CuSO4+H2↑,则a 极的反应式是_____,N 溶液为 _____溶液。
(3)工业上用 Na2SO3 溶液吸收 SO2,过程中往往得到 Na2SO3 和 NaHSO3的混合溶液,溶液 pH 随 n(![]() ):n(
):n(![]() ) 变化关系如下表:
) 变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图示回答:

①![]() 在阳极放电的电极反应式是_____。
在阳极放电的电极反应式是_____。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:_____。