题目内容
【题目】将镁条置于 pH=8.4 的饱和 NaHCO3 溶液中,镁条表面产生气体 a,一段时间后产生白色沉淀b。继续进行如下实验:
Ⅰ.将 a 通过澄清石灰水,变浑浊,继而通过足量 NaOH 溶液,再通入肥皂液,出现气泡,点燃气泡听到爆鸣声;
Ⅱ.向沉淀 b 中加入足量的稀盐酸,沉淀完全溶解,且产生无色气泡。下列说法不正确的是
A.饱和 NaHCO3 溶液中,c(![]() )< c(H2CO3)
)< c(H2CO3)
B.沉淀 b 是 MgCO3
C.气体 a 中含有 CO2 和 H2
D.CO2 可能是 ![]() 水解被促进产生的
水解被促进产生的
【答案】B
【解析】
饱和NaHCO3溶液的pH=8.4,说明在溶液中以![]() 水解为主。实验Ⅰ,将 a通过澄清石灰水,变浑浊,表明a中含有CO2,继而通过足量 NaOH 溶液除去CO2,再通入肥皂液,出现气泡,点燃气泡听到爆鸣声,表明a中含有H2;实验Ⅱ,向沉淀 b 中加入足量的稀盐酸,沉淀完全溶解,且产生无色气泡,表明b中一定含有MgCO3,可能含有Mg(OH)2。
水解为主。实验Ⅰ,将 a通过澄清石灰水,变浑浊,表明a中含有CO2,继而通过足量 NaOH 溶液除去CO2,再通入肥皂液,出现气泡,点燃气泡听到爆鸣声,表明a中含有H2;实验Ⅱ,向沉淀 b 中加入足量的稀盐酸,沉淀完全溶解,且产生无色气泡,表明b中一定含有MgCO3,可能含有Mg(OH)2。
A.饱和NaHCO3溶液呈碱性,表明![]() 的水解趋势大于电离趋势,所以c(
的水解趋势大于电离趋势,所以c(![]() )< c(H2CO3),A正确;
)< c(H2CO3),A正确;
B.由于Mg(OH)2比MgCO3更难溶,沉淀趋向于向生成Mg(OH)2的方向转化,但沉淀与盐酸反应有气泡产生,所以沉淀 b 应为MgCO3与Mg(OH)2的混合物,B错误;
C.由以上分析知,气体 a 中含有CO2(使澄清石灰水变浑浊) 和H2(点燃气泡听到爆鸣声),C正确;
D.CO2可能是 ![]() 水解生成的H2CO3发生分解生成,所以
水解生成的H2CO3发生分解生成,所以![]() 水解被促进,D正确;
水解被促进,D正确;
故选B。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】(1)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 |
| 142 |
| 2560 | Br- | 64 |
Mg2+ | 1272 |
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴(阳)离子通过。
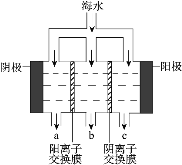
①电解氯化钠溶液的离子方程式_____。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因_____。 在阴极附近产生少量白色沉淀,其成分有_________和CaCO3。
③淡水的出口为_________(填“a”、“b”或“c”);a 出口物质为_____(填化学式)。
④若用下面燃料电池为电源电解 100mL1molL-1 氯化钠溶液,当电池消耗0.00025 molO2 时,常温下,所得溶液的 pH 为__________(忽略反应前后溶液体积变化)
(2)如图Ⅰ是氢氧燃料电池(电解质为 KOH 溶液)的结构示意图,
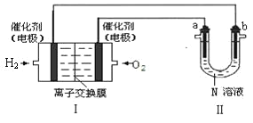
①Ⅰ中通入O2的一端为电池的_____极。 通入H2的一端的电极反应式_________
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是_____,N 溶液为_____溶液。
③若在Ⅱ中实现 Cu+H2SO4= CuSO4+H2↑,则a 极的反应式是_____,N 溶液为 _____溶液。
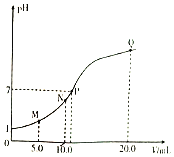
(3)工业上用 Na2SO3 溶液吸收 SO2,过程中往往得到 Na2SO3 和 NaHSO3的混合溶液,溶液 pH 随 n(![]() ):n(
):n(![]() ) 变化关系如下表:
) 变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图示回答:

①![]() 在阳极放电的电极反应式是_____。
在阳极放电的电极反应式是_____。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:_____。
【题目】物质a、b、c、d均为中学化学中的常见单质或化合物,它们之间的转化关系如右图所示(部分产物已略去),下列各组物质中,通过一步反应就能实现图示转化的是
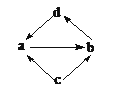
选项 | a | b | c | d |
A | SO2 | SO3 | S | H2SO4 |
B | Na2O | Na2O2 | Na | NaOH |
C | CO | CO2 | C | H2CO3 |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.AB.BC.CD.D