题目内容
钢铁是21世纪用途最广的结构材料和功能材料。其成分主要是Fe和少量C。
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目 。
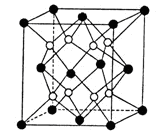
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为 。
(3)Fe3+的电子排布式为 ;CH3+微粒的中心原子杂化轨道类型为 ;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡 (用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象 。(不考虑SCN—与Mg2+反应)
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目 。
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为 。

(3)Fe3+的电子排布式为 ;CH3+微粒的中心原子杂化轨道类型为 ;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡 (用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象 。(不考虑SCN—与Mg2+反应)
(1)

(2)FeMg2
(3)1S22S23S23P63d5 SP2
Fe2++3SCN-
 Fe(SCN-)3 (红色) 由于氢氧化铁的溶解度小于氢氧化镁的溶解度,向上述体系中加入氢氧化镁后,发生沉淀转化:氢氧化镁沉淀转化成氢氧化铁沉淀,消耗了三价铁离子,使Fe2++3SCN-
Fe(SCN-)3 (红色) 由于氢氧化铁的溶解度小于氢氧化镁的溶解度,向上述体系中加入氢氧化镁后,发生沉淀转化:氢氧化镁沉淀转化成氢氧化铁沉淀,消耗了三价铁离子,使Fe2++3SCN- Fe(SCN-)3 平衡向左移动,Fe(SCN-)3 减少。
Fe(SCN-)3 平衡向左移动,Fe(SCN-)3 减少。试题分析:(1)根据元素守恒和质量守恒定律,不难写出相关化学方程式和画出单线桥;(2)利用均摊法,
Fe:8×
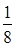 +6×
+6×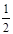 =4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数:
=4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数: =0,
=0,价层电子对数为4,杂化轨道类型SP2。(4)存在平衡Fe3++3SCN-
 Fe(SCN)3,根据勒夏特列原理不
Fe(SCN)3,根据勒夏特列原理不难判断化学平衡的移动方向。

练习册系列答案
相关题目
 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是 2CH3COOH(g)经试验测得在不同压强下体系的平均相对分子质量(M)随温度T的变化曲线如图所示,下列说法正确的是
2CH3COOH(g)经试验测得在不同压强下体系的平均相对分子质量(M)随温度T的变化曲线如图所示,下列说法正确的是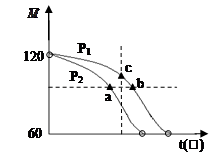
 是一个关键的步骤。
是一个关键的步骤。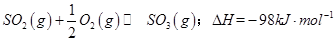 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。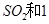 mol
mol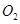 ,发生反应:
,发生反应: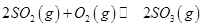 ,达平衡后改变下述条件,
,达平衡后改变下述条件, 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。

 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。 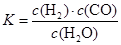
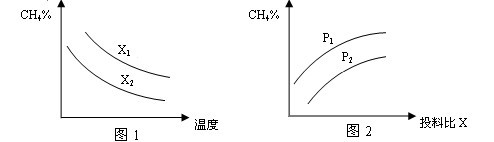
 N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表: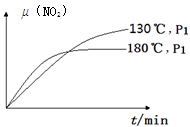
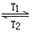 WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是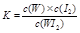
 Cr2O72-
Cr2O72-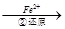 Cr3+
Cr3+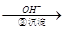 Cr(OH)3↓
Cr(OH)3↓  Cr2O72- (橙色)+H2O
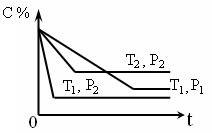
Cr2O72- (橙色)+H2O xC(g),在密闭容器中进行,下图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是( )
xC(g),在密闭容器中进行,下图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是( )