��Ŀ����
��ҵ������ʱ�����ô�������Ӧ�� ��һ���ؼ��IJ��衣
��һ���ؼ��IJ��衣
��1��ij�¶��£�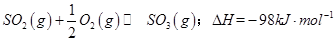 ����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________��
����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________��
��2��һ�������£���һ���������ܱ������г���2mol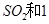 mol
mol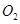 ,������Ӧ:
,������Ӧ: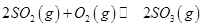 ,��ƽ���ı�����������
,��ƽ���ı�����������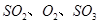 ����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��
����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��
E�������¶�
��3�����й���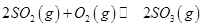 ��Ӧ��ͼ���У�����ȷ����_________��
��Ӧ��ͼ���У�����ȷ����_________��

��4��ͬѧ��ѧϰ�˵绯ѧ֪ʶ��������������õ��ķ������������ᣬ�ɱ���������꣬��Ⱦ���������Ǵ�������һ���Բ�Ϊ�缫�������ֱ�ͨ��SO2�Ϳ��������Ե��Һ��ʵ�ֵ���������ᡣ
�������ĵ缫��ӦΪ______________________________��
�������ҺΪ2L0.025mol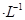 ��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)��
��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)��
����ƴ�ʵ����뷨�õ�����ʦ�ij�ֿ϶������빤ҵ������������Ȼ����кܶ�㣬��Դ�ʵ����к���������____________________________��д��һ�㼴�ɣ���
 ��һ���ؼ��IJ��衣
��һ���ؼ��IJ��衣��1��ij�¶��£�
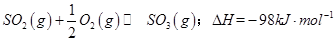 ����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________��
����ʼʱ��100L���ܱ������м���4.0molSO2(g)��10.0molO2������Ӧ�ﵽƽ��ʱ���ų�����196kJ�����¶���ƽ�ⳣ��K=____________����2��һ�������£���һ���������ܱ������г���2mol
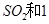 mol
mol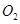 ,������Ӧ:
,������Ӧ: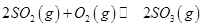 ,��ƽ���ı�����������
,��ƽ���ı�����������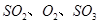 ����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��
����ƽ��Ũ�ȶ���ԭ���������____________(����ĸ)��A�������¶Ⱥ�����������䣬����2mol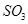 |
| B�������¶Ⱥ�����������䣬����2molN2 |
C�������¶Ⱥ�������ѹǿ���䣬����1mol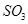 |
| D���ƶ�����ѹ������ |
��3�������
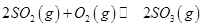 ��Ӧ��ͼ���У�����ȷ����_________��
��Ӧ��ͼ���У�����ȷ����_________��
��4��ͬѧ��ѧϰ�˵绯ѧ֪ʶ��������������õ��ķ������������ᣬ�ɱ���������꣬��Ⱦ���������Ǵ�������һ���Բ�Ϊ�缫�������ֱ�ͨ��SO2�Ϳ��������Ե��Һ��ʵ�ֵ���������ᡣ
�������ĵ缫��ӦΪ______________________________��
�������ҺΪ2L0.025mol
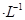 ��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)��
��������Һ���������̹�ת����0.1mol����ʱ������������SO2�����Ϊ����״����Ϊ_________������Һ��pH="__________" (������Һ����仯)�� ����ƴ�ʵ����뷨�õ�����ʦ�ij�ֿ϶������빤ҵ������������Ȼ����кܶ�㣬��Դ�ʵ����к���������____________________________��д��һ�㼴�ɣ���
��ÿ��2�֣�
��1��10/3��3.33
��2��A��D
��3��C
��4��2SO2 �C 4e? + 4H2O = 2SO42? +8H+ 1.12L 1
�ķѴ����ĵ��ܣ������ã����ʵͣ����ܴ��ģ����
��1��10/3��3.33
��2��A��D
��3��C
��4��2SO2 �C 4e? + 4H2O = 2SO42? +8H+ 1.12L 1
�ķѴ����ĵ��ܣ������ã����ʵͣ����ܴ��ģ����
��������� ��1��ת����SO2Ϊ��196kJ��98kJ?mol?1=2mol,��������ʽ���㣺
SO2 +
 O2
O2 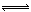 SO3
SO3 ��ʼŨ�ȣ�mol?L?1�� 0.04 0.1 0
ת��Ũ�ȣ�mol?L?1�� 0.02 0.01 0.02
ƽ��Ũ�ȣ�mol?L?1�� 0.02 0.09 0.02
�ɵ�ƽ�ⳣ��K=0.02�£�0.02��
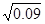 =10/3
=10/3��2��A������SO3��ƽ�������ƶ�������Ũ�ȶ�����B��N2�뷴Ӧ�أ�����Ũ�ȶ����䣻C������ѹǿ���䣬����SO3�����ݵ�Чƽ��ԭ��������Ũ�Ȳ��䣻D����ѹ������ʵ�Ũ�ȶ�����ԭƽ�⣻E�������¶ȣ�ƽ�������ƶ���SO2��O2Ũ������SO3Ũ�ȼ�С��
��3��A���¶����ߣ�ƽ�������ƶ����淴Ӧ�������ӵı�������ȷ��B��ͼ���ǰ���Ϊ��Ӧ����ƽ��Ĺ��̣�SO3%������T1֮��Ľ�Ϊ��ѧ��Ӧ���¶ȵ�����ƽ���ƶ��Ĺ��̣������¶ȣ�ƽ�������ƶ�SO3%��С��ͼ����ȷ��C��600�����500�棬ƽ�������ƶ���SO3%��С��ͼ�����D������ѹǿ��ƽ�������ƶ���SO3%����ͼ����ȷ��
��4���������Ϸ���ʧ���ӷ�Ӧ��SO2ʧ��������SO42?��
��V(SO2) =0.1mol��2��22.4L/mol=1.12L��
pH=-lg��0.1mol��2��2L��=1
�۵����Ҫ���Ĵ����ĵ��ܣ����Ա���ƺķѴ����ĵ��ܣ������ã����ʵͣ����ܴ��ģ������

��ϰ��ϵ�д�
�����Ŀ
 nY(g) ��H=QkJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ������˵����ȷ����
nY(g) ��H=QkJ/mol����Ӧ�ﵽƽ��ʱ��Y�����ʵ���Ũ�����¶ȡ���������Ĺ�ϵ���±���ʾ������˵����ȷ���� 2SO3(g)�ﵽƽ��״̬�ı�־��______��
2SO3(g)�ﵽƽ��״̬�ı�־��______��
 O2(g)
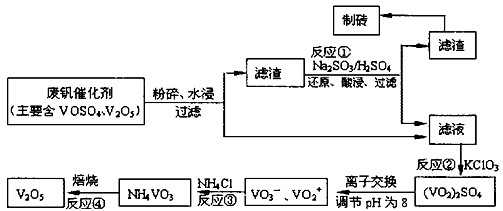
O2(g)  ��̼��������Ĺ�ҵ����ԭ������ͼ��Ͷ�ϱ�[
��̼��������Ĺ�ҵ����ԭ������ͼ��Ͷ�ϱ�[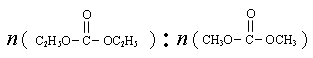 ]�ֱ�Ϊ3�U1��1�U1����Ӧ��������ʵ�����ͬʱ��
]�ֱ�Ϊ3�U1��1�U1����Ӧ��������ʵ�����ͬʱ�� ��ƽ��ת�������¶ȵĹ�ϵ���ߡ�����˵����ȷ����
��ƽ��ת�������¶ȵĹ�ϵ���ߡ�����˵����ȷ����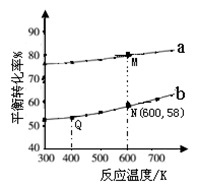
 2SO3(g) ��H��0�����ݻ�Ϊ2.0 L���ܱ������г���2 mol SO2��1 mol O2��һ�������´ﵽƽ�⣬SO3���������Ϊ
2SO3(g) ��H��0�����ݻ�Ϊ2.0 L���ܱ������г���2 mol SO2��1 mol O2��һ�������´ﵽƽ�⣬SO3���������Ϊ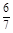 ��
��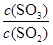 �������_____��
�������_____�� xC(g)��H=-192kJ��mol-1,��M��N�ж�ͨ��1molA��2molB�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䡣����˵����ȷ���� ( )
xC(g)��H=-192kJ��mol-1,��M��N�ж�ͨ��1molA��2molB�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䡣����˵����ȷ���� ( )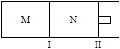
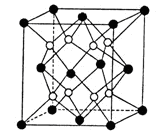
 C(g)��D(g)�ﵽƽ��������¶�������������ܶ�������ش��������⣺
C(g)��D(g)�ﵽƽ��������¶�������������ܶ�������ش��������⣺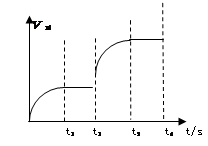
 zC�ﵽƽ�⣺
zC�ﵽƽ�⣺