题目内容
按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为: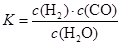
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
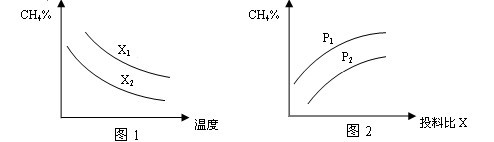
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为:
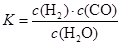
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
(14分毎空2分)
Ⅰ、(1) C(S)+H2O(g) H2(g) + CO(g) (可不标状态,不写可逆号0分)
H2(g) + CO(g) (可不标状态,不写可逆号0分)
(2) ①< ;②<
(3)①c(K+)>c(HCO3-)>cCO32-)>c(OH-)>c(H+);②C6H12O6-24e-+6H2O=6CO2+24H+
Ⅱ、(1)10︰1 (2)2×10-9/(c-0.02)
Ⅰ、(1) C(S)+H2O(g)
 H2(g) + CO(g) (可不标状态,不写可逆号0分)
H2(g) + CO(g) (可不标状态,不写可逆号0分) (2) ①< ;②<
(3)①c(K+)>c(HCO3-)>cCO32-)>c(OH-)>c(H+);②C6H12O6-24e-+6H2O=6CO2+24H+
Ⅱ、(1)10︰1 (2)2×10-9/(c-0.02)
试题分析:Ⅰ、(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据平衡常数的表达式可知,该反应的化学方程式是C(S)+H2O(g)
 H2(g)+CO(g)。
H2(g)+CO(g)。(2)①根据反应的化学方程式CH4+H2O
 CO+3H2可知,在温度相同时,投料比越大,甲烷的转化率越低,则容器中甲烷的含量越高,所以根据图像1可知,X2<X1。
CO+3H2可知,在温度相同时,投料比越大,甲烷的转化率越低,则容器中甲烷的含量越高,所以根据图像1可知,X2<X1。②根据方程式可知,该反应是体积增大的,所以在投料比相同的条件下,压强越大,甲烷的转化率越小,则甲烷的含量越高,所以根据图 2可知,P2<P1。
(3)①在该燃料电池中,甲烷在负极通入,氧气在正极通入。参加反应的氧气是0.2mol,得到0.8mol电子,所以消耗甲烷的物质的量是0.8mol÷8=0.1mol,生成CO2是0.1mol,但溶液中氢氧化钾是0.15mol,所以反应中生成碳酸钾和碳酸氢钾,且二者的物质的量均是0.05mol。由于CO32-的水解程度大于HCO3-的水解程度,所以放电后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>cCO32-)>c(OH-)>c(H+)。
②原电池中负极失去电子,所以葡萄糖在负极放电,电极反应式是C6H12O6-24e-+6H2O=6CO2+24H+。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,所以该温度下水的离子积常数=1×10-13,所以pH=12的NaOH溶液中OH-的浓度是0.1mol/L。所得混合液为中性,这说明二者恰好反应,则VaL×0.01mol/L=VbL×0.1mol/L,解得Va︰Vb=10︰1。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,因此根据电荷守恒可知,溶液中c(CH3COO-)=c(Na+)=0.01mol/L,则溶液中c(CH3COOH)=(0.5c-0.01)mol/L。又因为溶液中c(H+)=1×10-7mol/L,所以根据醋酸的电离常数表达式可知Ka=
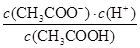 =2×10-9/(c-0.02)。
=2×10-9/(c-0.02)。
练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
 Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
 B(g)+C(g);ΔH ="-48.25" kJ · mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,则下列结论正确的是
B(g)+C(g);ΔH ="-48.25" kJ · mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)="1.6" mol·L-1,则下列结论正确的是

 2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g) ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。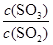 增大的是_____。
增大的是_____。
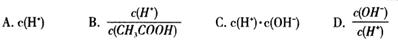

 pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
 2HI(g)达到化学平衡状态的标志是( )
2HI(g)达到化学平衡状态的标志是( )