题目内容
【题目】常温时,浓度均为1mol·L-1的CH3NH2和NH2OH两种碱溶液,起始时的体积都为10mL。分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lg[c(OH-)]。下列说法正确的是( )
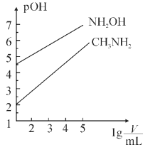
A.当两溶液均稀释至lg![]() =5时,溶液中水的电离程度:NH2OH<CH3NH2
=5时,溶液中水的电离程度:NH2OH<CH3NH2
B.常温下,用盐酸滴定NH2OH时,可用酚酞作指示剂
C.CH3NH3Cl溶液中存在关系:2c(H+)+c(CH3NH)=c(CH3NH2)+2c(OH-)+c(Cl-)
D.等浓度的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系为:c(NH3OH+)>c(CH3NH+)
【答案】C
【解析】
根据图示,二者稀释相同的倍数,NH2OH的pOH值大于CH3NH2溶液,pOH越小,碱性越强,则NH2OH的碱性弱于CH3NH2,据此分析解答。
A.当两溶液均稀释至lg![]() =5时,NH2OH的pOH值大于CH3NH2溶液,pOH越小,碱性越强,对水的电离抑制作用越大,则溶液中中水的电离程度:NH2OH>CH3NH2,故A错误;
=5时,NH2OH的pOH值大于CH3NH2溶液,pOH越小,碱性越强,对水的电离抑制作用越大,则溶液中中水的电离程度:NH2OH>CH3NH2,故A错误;
B.常温下,用盐酸滴定NH2OH达到终点时生成的NH3OHCl为酸性,应用甲基橙作指示剂,故B错误;
C.CH3NH3Cl溶液中存在电荷守恒:c(H+)+c(CH3NH3+)=c(OH-)+c(Cl-),质子守恒式为:c(H+)=c(CH3NH2)+c(OH-),两式相加可得:2c(H+)+c(CH3NH3+)=c(CH3NH2)+2c(OH-)+c(Cl-),故C正确;
D.1molL1的CH3NH2比1molL1的NH2OH的pOH值小,即碱性强,根据水解规律,越弱越水解,NH3OH+的水解程度大,所以浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:c(NH3OH+)<c(CH3NH3+),故D错误;
答案选C。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示。请回答下列问题:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
(1)反应②是____(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=____(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在____(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)___v(逆)(填“>”、“=”或“<”)。
(4)根据上述表格测得焓变,下列能量关系图合理的是_____
A. B.
B.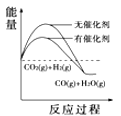 C.
C.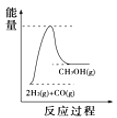 D.
D.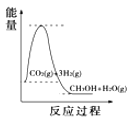
【题目】欲测定某NaOHmolL-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为______________;
(2)盛装标准盐酸的仪器名称为______________;
(3)滴定至终点的颜色变化为______________;
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为______________;

(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为______________; (保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/mL | 0.1000molL-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(6)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.