题目内容
【题目】欲测定某NaOHmolL-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为______________;
(2)盛装标准盐酸的仪器名称为______________;
(3)滴定至终点的颜色变化为______________;
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为______________;

(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为______________; (保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/mL | 0.1000molL-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(6)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
【答案】(1)锥形瓶 (2)酸式滴定管 (3)溶液由黄色变为橙色且半分钟内不褪色
(4) 26.90mL (5)0.1052mol/L (6)AC
【解析】
试题分析:(1)用酸式滴定管取待测待测NaOH溶液于锥形瓶中;
(2)盛装标准盐酸的仪器名称为酸式滴定管;
(3)待测液是氢氧化钠,锥形瓶中盛有的氢氧化钠溶液中滴入甲基橙,溶液的颜色是黄色,随着溶液的pH减小,当滴到溶液的pH小于4.4时,溶液颜色由黄色变成橙色,且半分钟不褪色,滴到结束;
(4)甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图为27.40ml,滴定管中的液面读数为27.40ml-0.50mL=26.90mL;
(5)根据数据的有效性,舍去第2组数据,则1、3组平均消耗V(盐酸)=![]() =26.30mL,
=26.30mL,
HCl+NaOH═NaCl+H2O
0.0263L×0.1000molL-1 0.025L×C(NaOH)
则C(NaOH)=![]() =0.1052mol/L;
=0.1052mol/L;
(6)A.锥形瓶用蒸馏水洗净后再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏
大,根据c(待测)=![]() 分析,造成c(待测)偏高,故A正确;B.酸式滴定管用蒸馏水洗净后再用标准液润洗,对V(标准)无影响,根据c(待测)=
分析,造成c(待测)偏高,故A正确;B.酸式滴定管用蒸馏水洗净后再用标准液润洗,对V(标准)无影响,根据c(待测)=![]() 分析,造成c(待测)不变,故B错误;C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,会造成V(标准)偏大,根据c(待测)=
分析,造成c(待测)不变,故B错误;C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,会造成V(标准)偏大,根据c(待测)=![]() 分析,造成c(待测)偏高,故C正确;D.滴定前读数正确,滴定后俯视滴定管读数,会造成V(标准)偏小,根据c(待测)=
分析,造成c(待测)偏高,故C正确;D.滴定前读数正确,滴定后俯视滴定管读数,会造成V(标准)偏小,根据c(待测)=![]() 分析,造成c(待测)偏低,故D错误;故选AC。
分析,造成c(待测)偏低,故D错误;故选AC。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。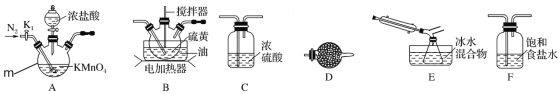
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
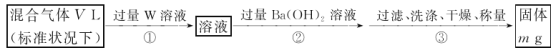
①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。