题目内容
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示。请回答下列问题:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
(1)反应②是____(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=____(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在____(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)___v(逆)(填“>”、“=”或“<”)。
(4)根据上述表格测得焓变,下列能量关系图合理的是_____
A. B.
B. C.
C.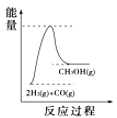 D.
D.
【答案】吸热 K1·K2 < 较低 > AD
【解析】
根据反应①②的平衡常数随温度的变化分析判断反应①和②的热效应的变化,再根据盖斯定律结合K分析判断反应③的热效应的变化,最后结合化学平衡常数的表达式分析解答。
(1)根据表格数据,反应②CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数随温度升高增大,说明升高温度平衡正向移动,正反应是吸热反应,故答案为:吸热;
CO(g)+H2O(g)的平衡常数随温度升高增大,说明升高温度平衡正向移动,正反应是吸热反应,故答案为:吸热;
(2)根据盖斯定律,反应①+②可得反应③,则平衡常数K3=K1×K2,反应③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应,则△S<0;反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.52×0.15=0.375,随温度升高,平衡常数减小,说明平衡逆向移动,所以反应③是放热反应,焓变△H<0,所以反应在低温下能自发进行,故答案为:K1×K2;<;较低;
CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应,则△S<0;反应③的平衡常数,500°C时,K3=K1×K2=2.5×1.0=2.5,800°C时,K3=K1×K2=2.52×0.15=0.375,随温度升高,平衡常数减小,说明平衡逆向移动,所以反应③是放热反应,焓变△H<0,所以反应在低温下能自发进行,故答案为:K1×K2;<;较低;
(3)500℃时K3=K1×K2=2.5,浓度商Qc=![]() =0.87<K=2.5,平衡向正反应移动,则v(正)>v(逆),故答案为:>;
=0.87<K=2.5,平衡向正反应移动,则v(正)>v(逆),故答案为:>;
(4)A、反应②CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数随温度升高而增大,说明升高温度平衡正向移动,正反应是吸热反应,反应物能量低于生成物,与图象符合,故A正确;B、催化剂改变反应的活化能,不改变焓变,根据A的分析,反应②为吸热反应,反应物能量低于生成物,与图象不符,故B错误;C、①2H2(g)+CO(g)CH3OH(g)的平衡常数随温度升高而减小,说明正反应为放热反应,反应物能量高于生成物,与图象不符,故C错误;D、根据(2)的分析,反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是放热反应,反应物能量高于生成物,与图象符合,故D正确;故答案为:AD;
CO(g)+H2O(g)的平衡常数随温度升高而增大,说明升高温度平衡正向移动,正反应是吸热反应,反应物能量低于生成物,与图象符合,故A正确;B、催化剂改变反应的活化能,不改变焓变,根据A的分析,反应②为吸热反应,反应物能量低于生成物,与图象不符,故B错误;C、①2H2(g)+CO(g)CH3OH(g)的平衡常数随温度升高而减小,说明正反应为放热反应,反应物能量高于生成物,与图象不符,故C错误;D、根据(2)的分析,反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是放热反应,反应物能量高于生成物,与图象符合,故D正确;故答案为:AD;

 智能训练练测考系列答案
智能训练练测考系列答案【题目】X、Y两根金属棒插入Z溶液中构成如图所示装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB.BC.CD.D