题目内容
【题目】醇分子间脱水生成醚是制备简单醚的常用方法。用硫酸作为催化剂,在不同的温度下正丁醇和硫酸作用生成的产物会有不同,因此反应需严格控制温度。
主反应 ![]()
副反应 ![]()
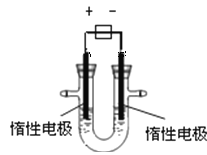
主要实验装置如图所示
主要试剂及产物的部分性质如下表所示
名称 | 正丁醇 | 正丁醚 | 浓硫酸 |
相对分子质量 | 74 | 130 | 98 |
性状 | 无色液体 | 无色液体 | 无色液体 |
相对密度 | 0.8098 | 0.7689 | 1.84 |
沸点/℃ | 117.7 | 142.4 | 340 |
溶解度/(g/100ml水) | 7.7 | <0.5 |
实验步骤如下:
①在干燥的100mL三颈烧瓶中,放入14.8g正丁醇和4g(2.2mL)浓硫酸,摇动混合,并加入几粒沸石。按装置图,一瓶口装上温度计,温度计的水银球浸入液面以下。另一瓶口装上油水分离器(分水器),先在分水器中放置VmL水,然后将三颈烧瓶在电热套中加热,使瓶内液体微沸,开始回流。
②随反应的进行,分水器中液面增高,这是由于反应生成的水,以及未反应的正丁醇(在三颈烧瓶中会有二元或三元恒沸物)蒸出,经冷凝管冷凝后聚集于分水器内。继续加热到瓶内温度升高到135℃左右。分水器已全部被水充满时,表示反应已基本完成,约需1h。如继续加热,则溶液容易碳化变黑,并有大量副产物生成。
③反应物冷却后,把混合物连同分水器里的水一起倒入盛有一定量水的分液漏斗中,充分振荡,静置后,分出产物粗制正丁醚。用16mL5.0mol/L硫酸分2次洗涤,再用10mL水洗涤,然后加入无水氯化钙。将干燥后的产物注入蒸馏烧瓶中,收集139~142℃馏分,产量为5.6g。
请回答下列问题:
(1)在三颈烧瓶中加入几粒沸石,目的是____________。
(2)仪器a的名称是_____________。
(3)先在分水器中放置VmL水,已知分水器的容积为10mL,试计算VmL为_____mL(保留两位有效数字)。
(4)实验装置图中分水器的作用是________________________________。
(5)反应温度不易过高,溶液容易碳化变黑,并有大量副产物_____________生成。
(6)实验过程中需用5.0mol/L硫酸分2次洗涤正丁醚,用浓硫酸配制5.0mol/L硫酸溶液时,定容的操作方法为___________________________________。
(7)在③步骤中用10mL水洗涤的目的是_________。
(8)本实验最终获得5.6g正丁醚,则产率为_________(保留三位有效数字)。
【答案】防止混合液受热暴沸 球形冷凝管 8.2 分离出水,使生成醚的可逆反应正向移动,由于正丁醇和正丁醚的密度比水小,在水的上层,会自动回流到三颈烧瓶中,提高反应物的转化率和产品的产率 1-丁烯 用玻璃棒引流向容量瓶中加蒸馏水至距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切 除硫酸 43.1%
【解析】
醇分子间脱水生成醚是,用硫酸作为催化剂,产物难溶于水,且与反应物沸点相差较大,故采用蒸馏、分液的操作得到粗品。依据实验基本操作分析,沸石防暴沸,冷凝管起到冷凝作用;依据丁醇加热反应生成丁醚的化学方程式,计算生成水的量,结合题干分水器被水充满计算加入的水的体积。
(1)在三颈烧瓶中加入几粒沸石,目的是防止混合液受热暴沸。
(2)根据仪器结构,仪器a的名称是球形冷凝管。
(3)先在分水器中放置VmL水,已知分水器的容积为10mL,14.8g正丁醇的物质的量为0.2mol,根据反应![]() ,理论生成水0.1mol,即1.8g;根据纯水的密度为1.0g/mL,生成水的体积为1.8mL, VmL为10mL-1.8mL=8.2mL。
,理论生成水0.1mol,即1.8g;根据纯水的密度为1.0g/mL,生成水的体积为1.8mL, VmL为10mL-1.8mL=8.2mL。
(4)实验装置图中分水器的作用是分离出水,使生成醚的可逆反应正向移动,由于正丁醇和正丁醚的密度比水小,在水的上层,会自动回流到三颈烧瓶中,提高反应物的转化率和产品的产率。
(5)根据题干,副反应方程为![]() ,反应温度不易过高,溶液容易碳化变黑,并有大量副产物1-丁烯生成。
,反应温度不易过高,溶液容易碳化变黑,并有大量副产物1-丁烯生成。
(6)实验过程中需用5.0mol/L硫酸分2次洗涤正丁醚,用浓硫酸配制5.0mol/L硫酸溶液时,定容的操作方法为用玻璃棒引流向容量瓶中加蒸馏水至距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切。
(7)实验先用硫酸洗涤,故在③步骤中用10mL水洗涤的目的是除硫酸。
(8) 14.8g正丁醇的物质的量为0.2mol,根据反应![]() ,理论上产物应为0.1mol,即获得正丁醚13g,本实验最终获得5.6g正丁醚,则产率为
,理论上产物应为0.1mol,即获得正丁醚13g,本实验最终获得5.6g正丁醚,则产率为![]() =43.1%。
=43.1%。

【题目】研究氮及其化合物的性质在人类进步过程中具有极为重要的意义
(1)研究表明,CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。由图可知总反应的化学反应速率由反应____(填“①”或“②”)决定。

(2)工业生产可以用NH3(g)与CO2(g)经两步可逆反应生成尿素,两步反应的能量变化示意图如下:
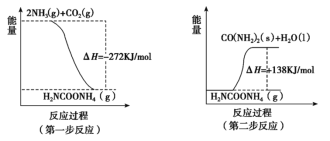
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为____________________。
(3)基元反应是指反应物直接转化为产物的反应。飞秒激光为代表的分子动力学可测得过程中出现的物质的光谱从而研究反应的机理,反应级数是速率方程中浓度项的幂次之和,用n表示。反应级数越大表示浓度对反应速率影响越大。已知:基元反应N2O5═N2O4+![]() O2 v═Kc(N2O5)是一级反应;则基元反应NO2+CO=CO2+NO v=Kc(NO2)c(CO)此反应为__________级反应。(两个方程涉及的物质均为气态)若v的单位为mol/(L·S),用n表示反应级数,则化学反应速率常数K的单位通式为_______________。
O2 v═Kc(N2O5)是一级反应;则基元反应NO2+CO=CO2+NO v=Kc(NO2)c(CO)此反应为__________级反应。(两个方程涉及的物质均为气态)若v的单位为mol/(L·S),用n表示反应级数,则化学反应速率常数K的单位通式为_______________。
(4)已知反应:2NO(g)+2H2(g)N2(g)+2H2O(g)在1L密闭容器中进行,该反应达到平衡过程测得下表数据。
实验序号 | 温度℃ | 初始NO浓度(mol·L-1) | 初始H2浓度(mol·L-1) | NO的平衡转化率 |
1 | 110 | 1.2 | 1.2 | a |
2 | 110 | 1.0 | 1.0 | 50% |
3 | 100 | 1.0 | 1.0 | b |
①在110 ℃时,此反应的化学平衡常数为________。
②在实验2的平衡体系中再加入1.0mol NO和
③实验1中,NO的转化率a________50%(填“>”、“=”或“<”)。实验3中,b的值________(填字母序号)。
A.等于50% B.大于50%
C.小于50% D.由本题所给资料无法判断
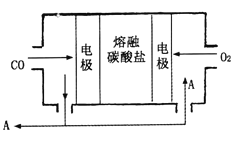
(5)一种直接肼燃料电池的结构如图所示,回答下列问题
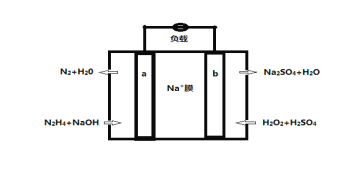
①b为电池的_________极
②负极的电极反应方程式为_________________________________
【题目】钛被誉为“21世纪的金属”,可呈现多种化合价,其中以+4价的Ti最为稳定。回答下列问题:
(1)基态Ti原子的价电子轨道表示式为 ___。
(2)已知电离能:I2(Ti)=1 310 kJ/mol,I2(K)=3051 kJ/mol,I2(Ti)<I2(K),其原因为_____________
(3)钛某配合物可用于催化环烯烃聚合,其结构如下图所示:
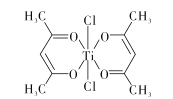
①钛的配位数为 ___,碳原子的杂化类型____。
②该配合物中存在的化学键有____(填字母代号)。
A.离子键 B.配位键 C.金属键 D.共价键 e.氢键
(4)钛与卤素形成的化合物熔沸点如下表所示:
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | -24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是_________________
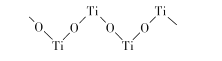
(5)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为____,阴离子的空间构型为__________ .
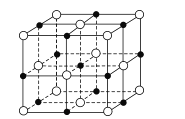
(6)已知TiN晶体的晶胞结构如图所示,若该晶胞的密度为ρg/cm3,阿伏加德罗常数值为NA,则晶胞中Ti原子与N原子的最近距离为____pm(用含p、NA的代数式表示)。