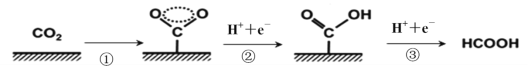
题目内容
【题目】研究氮及其化合物的性质在人类进步过程中具有极为重要的意义
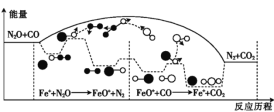
(1)研究表明,CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。由图可知总反应的化学反应速率由反应____(填“①”或“②”)决定。
(2)工业生产可以用NH3(g)与CO2(g)经两步可逆反应生成尿素,两步反应的能量变化示意图如下:
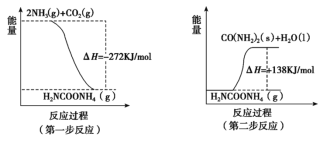
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为____________________。
(3)基元反应是指反应物直接转化为产物的反应。飞秒激光为代表的分子动力学可测得过程中出现的物质的光谱从而研究反应的机理,反应级数是速率方程中浓度项的幂次之和,用n表示。反应级数越大表示浓度对反应速率影响越大。已知:基元反应N2O5═N2O4+![]() O2 v═Kc(N2O5)是一级反应;则基元反应NO2+CO=CO2+NO v=Kc(NO2)c(CO)此反应为__________级反应。(两个方程涉及的物质均为气态)若v的单位为mol/(L·S),用n表示反应级数,则化学反应速率常数K的单位通式为_______________。
O2 v═Kc(N2O5)是一级反应;则基元反应NO2+CO=CO2+NO v=Kc(NO2)c(CO)此反应为__________级反应。(两个方程涉及的物质均为气态)若v的单位为mol/(L·S),用n表示反应级数,则化学反应速率常数K的单位通式为_______________。
(4)已知反应:2NO(g)+2H2(g)N2(g)+2H2O(g)在1L密闭容器中进行,该反应达到平衡过程测得下表数据。
实验序号 | 温度℃ | 初始NO浓度(mol·L-1) | 初始H2浓度(mol·L-1) | NO的平衡转化率 |
1 | 110 | 1.2 | 1.2 | a |
2 | 110 | 1.0 | 1.0 | 50% |
3 | 100 | 1.0 | 1.0 | b |
①在110 ℃时,此反应的化学平衡常数为________。
②在实验2的平衡体系中再加入1.0mol NO和
③实验1中,NO的转化率a________50%(填“>”、“=”或“<”)。实验3中,b的值________(填字母序号)。
A.等于50% B.大于50%
C.小于50% D.由本题所给资料无法判断
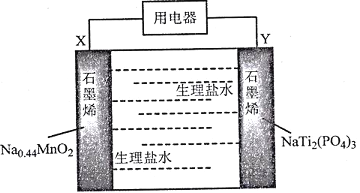
(5)一种直接肼燃料电池的结构如图所示,回答下列问题
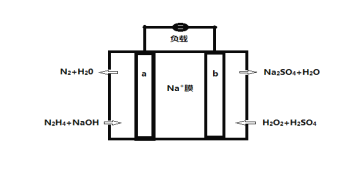
①b为电池的_________极
②负极的电极反应方程式为_________________________________
【答案】① 2NH3(g)+CO2(g)![]() CO(NH2)(s)+ H2O(l)△H=-134kJmol-1 二 或2 Ln-1.mol1-n.s-1 1 正反应 > D 正 负极的电极反应为: N2H4+4OH--4e-= N2↑+4H2O
CO(NH2)(s)+ H2O(l)△H=-134kJmol-1 二 或2 Ln-1.mol1-n.s-1 1 正反应 > D 正 负极的电极反应为: N2H4+4OH--4e-= N2↑+4H2O
【解析】
总反应的化学反应速率由速率慢的反应决定;热反应方程式反应热根据盖斯定律进行计算;根据化合价变化可知,过氧化氢发生还原反应生成水,N2H4发生氧化反应生成氮气,据此回答问题。
(1)两步反应分别为①N2O+Fe+=N2+FeO+(慢);②FeO++CO=CO2+Fe+(快)。总反应的化学反应速率由速率慢的反应①决定。
(2)根据盖斯定律,NH3(g)与CO2(g)反应生成尿素的热化学方程式为NH3(g)+CO2(g)![]() CO(NH2)(s)+ H2O(l)△H=-272kJmol-1+138kJmol-1=-134kJmol-1。
CO(NH2)(s)+ H2O(l)△H=-272kJmol-1+138kJmol-1=-134kJmol-1。
(3)反应级数是速率方程中浓度项的幂次之和,基元反应NO2+CO=CO2+NOv=Kc(NO2)c(CO),浓度项的幂次之和为2,此反应为二级反应。若v的单位为mol/(L·S),设产物为X,用n表示反应级数,则化学反应速率常数K=![]() ,单位通式为Ln-1.mol1-n.s-1。
,单位通式为Ln-1.mol1-n.s-1。
(4)已知反应:2NO(g)+2H2(g)N2(g)+2H2O(g)在1L密闭容器中进行,在110 ℃时该反应达到平衡过程,一氧化氮的转化率为50%,则平衡时一氧化氮的浓度为0.5mol/L,氢气的浓度为0.5mol/L,生成氮气的浓度为0.25mol/L,水的浓度为0.5mol/L。
①在110 ℃时,此反应的化学平衡常数为![]() 。
。
②在实验2的平衡体系中再加入1.0mol NO和0.5 mol N2,此时浓度商Q=![]() ,即平衡将向正方向移动。
,即平衡将向正方向移动。
③实验2与实验1比较,温度相同,实验1反应物浓度较大,故NO的转化率a>50%。反应的能量变化情况未知,反应热无法判断,故降低温度,转化率大小无法确定,选D由本题所给资料无法判断。
(5) ①根据题目箭头,a极失去电子,发生氧化反应,为负极;b极得到电子,发生还原反应,为正极。
②负极为N2H4生成氮气的反应,电极反应式为N2H4+4OH--4e-= N2↑+4H2O。

 阅读快车系列答案
阅读快车系列答案【题目】醇分子间脱水生成醚是制备简单醚的常用方法。用硫酸作为催化剂,在不同的温度下正丁醇和硫酸作用生成的产物会有不同,因此反应需严格控制温度。
主反应 ![]()
副反应 ![]()
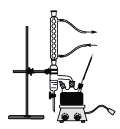
主要实验装置如图所示
主要试剂及产物的部分性质如下表所示
名称 | 正丁醇 | 正丁醚 | 浓硫酸 |
相对分子质量 | 74 | 130 | 98 |
性状 | 无色液体 | 无色液体 | 无色液体 |
相对密度 | 0.8098 | 0.7689 | 1.84 |
沸点/℃ | 117.7 | 142.4 | 340 |
溶解度/(g/100ml水) | 7.7 | <0.5 |
实验步骤如下:
①在干燥的100mL三颈烧瓶中,放入14.8g正丁醇和4g(2.2mL)浓硫酸,摇动混合,并加入几粒沸石。按装置图,一瓶口装上温度计,温度计的水银球浸入液面以下。另一瓶口装上油水分离器(分水器),先在分水器中放置VmL水,然后将三颈烧瓶在电热套中加热,使瓶内液体微沸,开始回流。
②随反应的进行,分水器中液面增高,这是由于反应生成的水,以及未反应的正丁醇(在三颈烧瓶中会有二元或三元恒沸物)蒸出,经冷凝管冷凝后聚集于分水器内。继续加热到瓶内温度升高到135℃左右。分水器已全部被水充满时,表示反应已基本完成,约需1h。如继续加热,则溶液容易碳化变黑,并有大量副产物生成。
③反应物冷却后,把混合物连同分水器里的水一起倒入盛有一定量水的分液漏斗中,充分振荡,静置后,分出产物粗制正丁醚。用16mL5.0mol/L硫酸分2次洗涤,再用10mL水洗涤,然后加入无水氯化钙。将干燥后的产物注入蒸馏烧瓶中,收集139~142℃馏分,产量为5.6g。
请回答下列问题:
(1)在三颈烧瓶中加入几粒沸石,目的是____________。
(2)仪器a的名称是_____________。
(3)先在分水器中放置VmL水,已知分水器的容积为10mL,试计算VmL为_____mL(保留两位有效数字)。
(4)实验装置图中分水器的作用是________________________________。
(5)反应温度不易过高,溶液容易碳化变黑,并有大量副产物_____________生成。
(6)实验过程中需用5.0mol/L硫酸分2次洗涤正丁醚,用浓硫酸配制5.0mol/L硫酸溶液时,定容的操作方法为___________________________________。
(7)在③步骤中用10mL水洗涤的目的是_________。
(8)本实验最终获得5.6g正丁醚,则产率为_________(保留三位有效数字)。