题目内容
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
【答案】0.3 mol·L-1 2∶1∶1 0.045
【解析】
(1)先计算c(SO42-),再结合电荷守恒分析;
(2)设K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积分别是xL、yL、zL,则0.2x=0.1×(x+y+z)、0.4y=0.1×(x+y+z)、0.1x+0.6y=0.2×(x+y+z),据此分析;
(3)HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,据此分析;
(1)根据反应Ba2++SO42-=BaSO4↓,混合溶液中加入等体积0.3 mol·L-1的BaCl2溶液恰好使SO42-完全沉淀,则c(SO42-)=0.3mol/L;由电荷守恒可得:3c(Al3+)+c(Na+)=2c(![]() ),所以c(Na+)=2c(
),所以c(Na+)=2c(![]() )-3c(Al3+)=2×0.3mol/L-3×0.1mol/L=0.3mol/L。
)-3c(Al3+)=2×0.3mol/L-3×0.1mol/L=0.3mol/L。
故答案为:0.3mol·L-1;
(2)设K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积分别是xL、yL、zL,则0.2x=0.1×(x+y+z)、0.4y=0.1×(x+y+z)、0.1x+0.6y=0.2×(x+y+z),解得x=2y=2z,所以K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比为2∶1∶1。
故答案为:2∶1∶1;
(3)HCl极易溶于水,氧气不易溶于水,所以水面上升的体积就是HCl的体积,设容器体积为VL,水面上升至集气瓶容积的![]() 就停止了,则氯化氢体积=
就停止了,则氯化氢体积=![]() VL,溶液体积为
VL,溶液体积为![]() VL,n(HCl)=
VL,n(HCl)=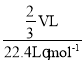 =
=![]() mol,盐酸浓度c=
mol,盐酸浓度c=![]() =
=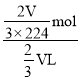 =
=![]() mol·L-1=0.045mol·L-1。
mol·L-1=0.045mol·L-1。
故答案为:0.045。

【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
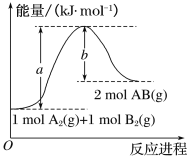
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
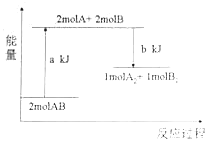
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。
【题目】醇分子间脱水生成醚是制备简单醚的常用方法。用硫酸作为催化剂,在不同的温度下正丁醇和硫酸作用生成的产物会有不同,因此反应需严格控制温度。
主反应 ![]()
副反应 ![]()
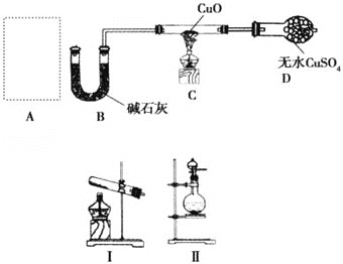
主要实验装置如图所示
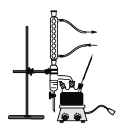
主要试剂及产物的部分性质如下表所示
名称 | 正丁醇 | 正丁醚 | 浓硫酸 |
相对分子质量 | 74 | 130 | 98 |
性状 | 无色液体 | 无色液体 | 无色液体 |
相对密度 | 0.8098 | 0.7689 | 1.84 |
沸点/℃ | 117.7 | 142.4 | 340 |
溶解度/(g/100ml水) | 7.7 | <0.5 |
实验步骤如下:
①在干燥的100mL三颈烧瓶中,放入14.8g正丁醇和4g(2.2mL)浓硫酸,摇动混合,并加入几粒沸石。按装置图,一瓶口装上温度计,温度计的水银球浸入液面以下。另一瓶口装上油水分离器(分水器),先在分水器中放置VmL水,然后将三颈烧瓶在电热套中加热,使瓶内液体微沸,开始回流。
②随反应的进行,分水器中液面增高,这是由于反应生成的水,以及未反应的正丁醇(在三颈烧瓶中会有二元或三元恒沸物)蒸出,经冷凝管冷凝后聚集于分水器内。继续加热到瓶内温度升高到135℃左右。分水器已全部被水充满时,表示反应已基本完成,约需1h。如继续加热,则溶液容易碳化变黑,并有大量副产物生成。
③反应物冷却后,把混合物连同分水器里的水一起倒入盛有一定量水的分液漏斗中,充分振荡,静置后,分出产物粗制正丁醚。用16mL5.0mol/L硫酸分2次洗涤,再用10mL水洗涤,然后加入无水氯化钙。将干燥后的产物注入蒸馏烧瓶中,收集139~142℃馏分,产量为5.6g。
请回答下列问题:
(1)在三颈烧瓶中加入几粒沸石,目的是____________。
(2)仪器a的名称是_____________。
(3)先在分水器中放置VmL水,已知分水器的容积为10mL,试计算VmL为_____mL(保留两位有效数字)。
(4)实验装置图中分水器的作用是________________________________。
(5)反应温度不易过高,溶液容易碳化变黑,并有大量副产物_____________生成。
(6)实验过程中需用5.0mol/L硫酸分2次洗涤正丁醚,用浓硫酸配制5.0mol/L硫酸溶液时,定容的操作方法为___________________________________。
(7)在③步骤中用10mL水洗涤的目的是_________。
(8)本实验最终获得5.6g正丁醚,则产率为_________(保留三位有效数字)。