题目内容
【题目】钛被誉为“21世纪的金属”,可呈现多种化合价,其中以+4价的Ti最为稳定。回答下列问题:
(1)基态Ti原子的价电子轨道表示式为 ___。
(2)已知电离能:I2(Ti)=1 310 kJ/mol,I2(K)=3051 kJ/mol,I2(Ti)<I2(K),其原因为_____________
(3)钛某配合物可用于催化环烯烃聚合,其结构如下图所示:

①钛的配位数为 ___,碳原子的杂化类型____。
②该配合物中存在的化学键有____(填字母代号)。
A.离子键 B.配位键 C.金属键 D.共价键 e.氢键
(4)钛与卤素形成的化合物熔沸点如下表所示:
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | -24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是_________________
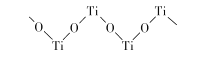
(5)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为____,阴离子的空间构型为__________ .
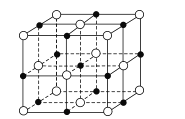
(6)已知TiN晶体的晶胞结构如图所示,若该晶胞的密度为ρg/cm3,阿伏加德罗常数值为NA,则晶胞中Ti原子与N原子的最近距离为____pm(用含p、NA的代数式表示)。
【答案】![]() K+失去的是全充满的3p6电子,Ti+失去的是4s1电子,相对较易失去,故I2(Ti)<I2(K) 6 sp3、sp2 BD 三者均为分子,组成与结构相似,随着相对分子质量的增大,分子间作用力增大,熔沸点升高 TiO2+ 正四面体
K+失去的是全充满的3p6电子,Ti+失去的是4s1电子,相对较易失去,故I2(Ti)<I2(K) 6 sp3、sp2 BD 三者均为分子,组成与结构相似,随着相对分子质量的增大,分子间作用力增大,熔沸点升高 TiO2+ 正四面体 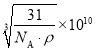
【解析】
(1)基态Ti原子的价电子排布式为3d24s2,由此可写出其价电子轨道表示式。
(2)已知电离能:I2(Ti)=1 310 kJ/mol,I2(K)=3051 kJ/mol,I2(Ti)<I2(K),原因从价电子轨道的能量寻找。
(3)①与钛形成共价键的数目有多少,配位数就为多少,从碳原子的价层电子对数进行分析。
②该配合物中,中心原子与配体间通过共用电子对形成化学键。
(4)TiCl4、TiBr4、TiI4都为分子晶体,其熔点和沸点与相对分子质量有关。
(5)该阳离子化学式为最简式,阴离子为SO42-,其空间构型满足AB4型分子结构。
(6)求出晶胞中所含有的原子数,从而可求出体积,再利用晶胞中Ti原子与N原子的最近距离表示体积,从而建立等量关系式,求出待求量。
(1) )基态Ti原子的价电子排布式为3d24s2,则基态Ti原子的价电子轨道表示式为![]() 。答案为:
。答案为:![]() ;
;
(2)从价电子轨道的能量看,K+失去的是全充满的3p6电子,Ti+失去的是4s1电子,相对较易失去,故I2(Ti)<I2(K)。答案为:K+失去的是全充满的3P6电子,Ti+失去的是4s1电子,相对较易失去,故I2(Ti)<I2(K);
(3)①从图中可以看出,Ti与6个原子形成共价键,所以钛的配位数为6;在配合物分子中,碳原子的价层电子对数分别为4和3,所以碳原子的杂化类型sp3、sp2。答案为:6;sp3、sp2;
②该配合物中,存在中心原子与配体间的配位键,其它非金属原子间的共价键,故选BD。答案为:BD;
(4)从表中数据看,TiCl4、TiBr4、TiI4都形成分子晶体,熔点和沸点呈现一定变化规律的原因是三者均为分子,组成与结构相似,随着相对分子质量的增大,分子间作用力增大,熔沸点升高。答案为:三者均为分子,组成与结构相似,随着相对分子质量的增大,分子间作用力增大,熔沸点升高;
(5) 根据均摊法该阳离子化学式为最简式TiO,又因为Ti为+4价,O为-2价,则化学式为TiO2+,阴离子为SO42-,其空间构型满足AB4型分子结构,即为正四面体。答案为:TiO2+;正四面体;
(6)在晶胞中,Ti原子数为8×![]() +6×
+6×![]() =4,N原子数为12×
=4,N原子数为12×![]() +1=4。
+1=4。
设则晶胞中Ti原子与N原子的最近距离为x
则有![]() ,x=
,x=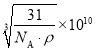 pm。答案为:
pm。答案为: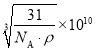 。
。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】醇分子间脱水生成醚是制备简单醚的常用方法。用硫酸作为催化剂,在不同的温度下正丁醇和硫酸作用生成的产物会有不同,因此反应需严格控制温度。
主反应 ![]()
副反应 ![]()
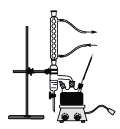
主要实验装置如图所示
主要试剂及产物的部分性质如下表所示
名称 | 正丁醇 | 正丁醚 | 浓硫酸 |
相对分子质量 | 74 | 130 | 98 |
性状 | 无色液体 | 无色液体 | 无色液体 |
相对密度 | 0.8098 | 0.7689 | 1.84 |
沸点/℃ | 117.7 | 142.4 | 340 |
溶解度/(g/100ml水) | 7.7 | <0.5 |
实验步骤如下:
①在干燥的100mL三颈烧瓶中,放入14.8g正丁醇和4g(2.2mL)浓硫酸,摇动混合,并加入几粒沸石。按装置图,一瓶口装上温度计,温度计的水银球浸入液面以下。另一瓶口装上油水分离器(分水器),先在分水器中放置VmL水,然后将三颈烧瓶在电热套中加热,使瓶内液体微沸,开始回流。
②随反应的进行,分水器中液面增高,这是由于反应生成的水,以及未反应的正丁醇(在三颈烧瓶中会有二元或三元恒沸物)蒸出,经冷凝管冷凝后聚集于分水器内。继续加热到瓶内温度升高到135℃左右。分水器已全部被水充满时,表示反应已基本完成,约需1h。如继续加热,则溶液容易碳化变黑,并有大量副产物生成。
③反应物冷却后,把混合物连同分水器里的水一起倒入盛有一定量水的分液漏斗中,充分振荡,静置后,分出产物粗制正丁醚。用16mL5.0mol/L硫酸分2次洗涤,再用10mL水洗涤,然后加入无水氯化钙。将干燥后的产物注入蒸馏烧瓶中,收集139~142℃馏分,产量为5.6g。
请回答下列问题:
(1)在三颈烧瓶中加入几粒沸石,目的是____________。
(2)仪器a的名称是_____________。
(3)先在分水器中放置VmL水,已知分水器的容积为10mL,试计算VmL为_____mL(保留两位有效数字)。
(4)实验装置图中分水器的作用是________________________________。
(5)反应温度不易过高,溶液容易碳化变黑,并有大量副产物_____________生成。
(6)实验过程中需用5.0mol/L硫酸分2次洗涤正丁醚,用浓硫酸配制5.0mol/L硫酸溶液时,定容的操作方法为___________________________________。
(7)在③步骤中用10mL水洗涤的目的是_________。
(8)本实验最终获得5.6g正丁醚,则产率为_________(保留三位有效数字)。