��Ŀ����
����Ŀ��������ũҵ��ҽҩ���������Ӧ�ù㷺����ҵ���ж��ֹ�����NH3��CO2ֱ�Ӻϳ����ء�
(1)ˮ��Һȫѭ�����ϳ����صķ�Ӧ���̿��������Ȼ�ѧ����ʽ��ʾ��
��ӦI 2NH3(1) +CO2(g)NH2 COONH4(1) ��H1 = - 119.2 kJmol-1
��ӦII NH2COONH4(1)CO(NH2)2(1)+ H2O(1) ��H2= 15.5 kJmol-1
��д��NH3(1)��CO2(g)��Ӧ����CO(NH2)2(1)��Һ̬ˮ���Ȼ�ѧ����ʽ��______��
�ڸù���Ҫ����190~ 200�桢13 ~ 24 MPa �������·�Ӧ��90�����ҷ�Ӧ��ʵ�����ƽ��ת���ʡ��Խ���ѡ���ѹ���������ɣ�_________��
(2)�ڲ�ͬ��̼��L=![]() ��ˮ̼��W=
��ˮ̼��W=![]() ������CO2ƽ��ת����x���¶�T�仯�����ͼ��ʾ��
������CO2ƽ��ת����x���¶�T�仯�����ͼ��ʾ��

��CO2ƽ��ת����x���¶�T������������С���Է���ԭ��_________��
����ͼ�У�����L=4��W=OʱCO2ƽ��ת����x���¶�T�仯������ʾ��ͼ____��
(3)ʵ����ģ������ѭ�����ϳ����أ�T���ʱ����5.6mol NH3��5.2molCO2���ݻ��㶨Ϊ0.5L�ĺ����ܱ������з�����Ӧ��2NH3(g)+CO2(g)CO(NH2)2(s)+H2O (g) ��H1����43kJmol-1���ﵽƽ��״̬ʱ��NH3��CO2��ƽ���ѹ֮�� p(NH3): p(CO2)= 2:13��[p(NH3)= x(NH3)p��x(NH3)Ϊƽ����ϵ��NH3�����ʵ���������pΪƽ����ѹ]��
��T ��ʱ���÷�Ӧ��ƽ�ⳣ�� K = ______________��
���������Ǹ���Ӧ�����ڸ÷�Ӧ��ϵ������˵����ȷ���� _________ ��
A.����Ӧ��ϵ��������ӵ�ƽ��Ħ���������ֲ���ʱ����Ӧ�ﵽƽ��״̬
B.��ͬ�����£����ˮ̼�ȻͰ�̼�ȶ���ʹNH3 ��ƽ��ת���ʽ���
C.�������м���CaO��(���� H2O��Ӧ)�����CO(NH2)2����
D.��Ӧ��ʼ���һ��ʱ���ڣ��ʵ����¿���ߵ�λʱ����CO2��ת����
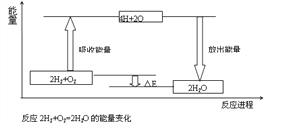
���𰸡�2NH3(l)+ CO2(g)CO(NH2)2 (l)+ H2O(l) ��H =-103.7kJ��mol-1 190~200��ʱ��NH 2COONH4 ���ֽ�Ϊ NH3��CO2����ѹ�����ڷ�ӦI������� �¶����ߣ���ӦIƽ�������ƶ�����ӦII ƽ�������ƶ�����190~200��֮ǰ����ӦII ������е����Ƹ���190~200�� ֮��ӦI������е����Ƹ���  1.5625 D
1.5625 D
��������
��1��ˮ��Һȫѭ�����ϳ����صķ�Ӧ���̿��������Ȼ�ѧ����ʽ��ʾ��
��ӦI 2NH3(1) +CO2(g)NH2 COONH4(1) ��H1 = - 119.2 kJmol-1
��ӦII NH2COONH4(1)CO(NH2)2(1)+ H2O(1) ��H2= 15.5 kJmol-1
�ٸ��ݸ�˹���ɣ���ӦI+��ӦII�ã�NH3(1)��CO2(g)��Ӧ����CO(NH2)2(1)��Һ̬ˮ���Ȼ�ѧ����ʽ��2NH3(l)+ CO2(g)CO(NH2)2 (l)+ H2O(l) ��H =-103.7kJ��mol-1���ʴ�Ϊ��2NH3(l)+ CO2(g)CO(NH2)2 (l)+ H2O(l) ��H2=-103.7kJ��mol-1��
�ڷ�ӦI 2NH3(1) +CO2(g)NH2 COONH4(1) �����������С�ķ�Ӧ��ѡ���ѹ���������ɣ�190~200��ʱ��NH 2COONH4 ���ֽ�Ϊ NH3��CO2����ѹ�����ڷ�ӦI������С��ʴ�Ϊ��190~200��ʱ��NH 2COONH4 ���ֽ�Ϊ NH3��CO2����ѹ�����ڷ�ӦI������У�
��2����CO2ƽ��ת����x���¶�T������������С����Ϊ���¶����ߣ���ӦIƽ�������ƶ�����ӦII ƽ�������ƶ�����190~200��֮ǰ����ӦII ������е����Ƹ���190~200�� ֮��ӦI������е����Ƹ��ʴ�Ϊ���¶����ߣ���ӦIƽ�������ƶ�����ӦII ƽ�������ƶ�����190~200��֮ǰ����ӦII ������е����Ƹ���190~200�� ֮��ӦI������е����Ƹ���
��LԽ���ı���Խ���ݷ�ӦI ����߰���Ũ�ȣ�������̼��ת������������Ӧ��ԭ����֮�ϣ��¶����ߣ���ӦIƽ�������ƶ�����ӦII ƽ�������ƶ�����190~200��֮ǰ����ӦII ������е����Ƹ���ת���������˺��С��L=4��W=OʱCO2ƽ��ת����x���¶�T�仯������ʾ��ͼ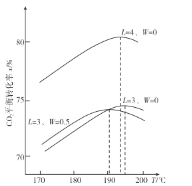 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3����T ��ʱ���÷�Ӧ��ƽ�ⳣ��:
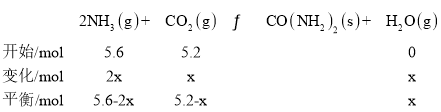
![]() ��
��
x=2.6mol
K= = 1.5625��
= 1.5625��
�ʴ�Ϊ��1.5625��
��A��2NH3(g)+CO2(g)CO(NH2)2(s)+H2O (g) �÷�Ӧ�У���ƽ�������ƶ������������������С�������ʵ���Ҳ��С�����Է�Ӧ��ϵ��������ӵ�ƽ��Ħ����������ȷ���Ƿֲ��䣬�ʵ���Ӧ��ϵ��������ӵ�ƽ��Ħ���������ٱ仯ʱ�������жϷ�Ӧ�Ƿ�ﵽƽ��״̬����A����
B����ͬ�����£����ˮ̼���൱�����������Ũ�ȣ�����ƽ��ת���ʽ��ͣ����Ͱ�̼�Ȼ�ʹNH3��ƽ��ת��������B����
C���������м���CaO��(���� H2O)��Ӧ�������ɵ���������Ҳ���뷴Ӧ�ﷴӦ������CO(NH2)2���ʣ���C����
D����Ӧ��ʼ���һ��ʱ���ڣ���û�дﵽƽ��ǰ���ʵ����¿���ߵ�λʱ����CO2��ת���ʣ���D��ȷ��
��ѡD��
�ʴ�Ϊ��D��

 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�����Ŀ���Լ���� CO2 �ĸ�Ч���ò����ܻ��������ů�����Ҷ�����ݽߵ�ʯ����ԴҲ��һ���IJ������ã������������ CO2 ������Ӧ�У�
��Ӧ(i)��2CH4(g)��O2(g)2CO(g)��4H2(g) �� H=��71.4kJmol-1
��Ӧ(ii)��CH4(g)��CO2(g)2CO(g)��2H2(g) �� H=+247.0 kJmol-1
(1)д����ʾ CO ȼ���ȵ��Ȼ�ѧ����ʽ��_____��
(2)�����������Ϊ 2L �ĺ����ܱ������У���ʼʱ��������Ӧ�����������ʣ�����ͬ�¶��½��з�Ӧ(ii)��CH4(g)��CO2(g)2CO(g)��2H2(g) (������������Ӧ)��CO2��ƽ��ת���������ʾ��
���� | ��ʼ���ʵ���(n) / mol | CO2��ƽ��ת���� | |||
CH4 | CO2 | CO | H2 | ||
�� | 0.1 | 0.1 | 0 | 0 | 50�� |
�� | 0.1 | 0.1 | 0.2 | 0.2 | / |
������������˵����Ӧ�ﵽƽ��״̬����_____��
A.v��(CH4) =2v��(CO)
B.�����ڸ����ʵ�Ũ������c(CH4)��c(CO2)=c2(CO)��c2(H2)
C.�����ڻ���������ѹǿ���ٱ仯
D.�����ڻ�������ܶȱ��ֲ���
�ڴﵽƽ��ʱ���������� CO �����ʵ����Ĺ�ϵ���㣺2n(CO)��_____n(CO)��(������������������������)
(3)��һ�����ļ�������������ɷ�Ӧ(i)������������ͬ���ڼס������ֲ�ͬ���������£� ��ͬʱ���ڲ�� CH4 ת�������¶ȱ仯��ϵ��ͼ��ʾ��c ��_____(��������������һ��������һ��δ��)�ﵽƽ��״̬��������_____��

(4)CO2 Ҳ��ͨ��������ϳ��Ҵ����䷴Ӧԭ��Ϊ��2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) H<0���� m Ϊ��ʼʱ��Ͷ�ϱȣ��� m= n(H2)/ n(CO2)��ͨ��ʵ��õ�����ͼ��
ͼ1 ͼ2
ͼ2 ͼ3
ͼ3
��ͼ 1 ��Ͷ�ϱ���ͬ���¶ȴӸߵ��͵�˳��Ϊ_________��
��ͼ 2 �� m1��m2��m3 �Ӵ�С��˳��Ϊ_________��
��ͼ 3 ��ʾ����ѹΪ 5 MPa �ĺ�ѹ�����£��� m=3 ʱ��ƽ��״̬ʱ�����ʵ����ʵ����������¶ȵĹ�ϵ��T4 �¶�ʱ���÷�Ӧѹǿƽ�ⳣ��KP�ļ���ʽΪ_________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ����������������ݣ����ü���)��
����Ŀ����������ʵ���ʵ��������������ý�����ȷ����
ʵ���ʵ����� | ���� | ʵ����� | |
A | �ô���ʯ�����ᷴӦ��ȡCO2���壬����ͨ��һ��Ũ�ȵ�Na2SiO3��Һ�� | ���ְ�ɫ���� | H2CO3�����Ա�H2SiO3������ǿ |
B | ��ij��Һ�ȵμ������ữ���ٵμ�BaCl2��Һ | ���ְ�ɫ���� | ԭ��Һ�к���SO42-��SO32-��HSO3-�е�һ�ֻ��� |
C | ����ZnƬ�봿CuƬ�õ������ӣ����뵽ϡ������Һ�� | CuƬ��������������� | �����ԣ�Zn��Cu |
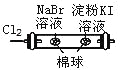
D |
| ��������Ϊ��ɫ���ұ������Ϊ��ɫ | �����ԣ�Cl2��Br2��I2 |
A. A B. B C. C D. D