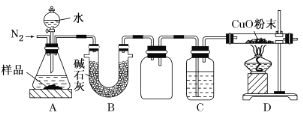
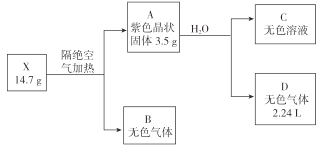
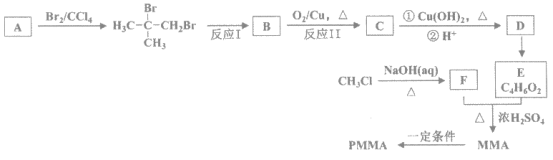
题目内容
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从3 min到9 min,υ(CO2)=______mol·L-1·min-1
(2)能说明上述反应达到平衡状态的是____________(填编号)
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成1 mol H2,同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO2的转化率为________%
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是____________。
(5)第3 min时υ正(CH3OH)___________第9 min时υ逆(CH3OH)(填“>”、“<”或“=”)。
【答案】0.042 BD 75 22:3 >
【解析】
(1)根据v=![]() 计算;
计算;
(2)反应达到平衡时任何物质的物质的量、浓度、含量等保持不变,据此判断;
(3)根据转化率=![]() ×100%计算;
×100%计算;
(4)根据加入的反应物的物质的量及物质反应转化关系判断平衡时两种气体的物质的量关系,然后计算二者的质量之比;
(5)第9 min时反应达到平衡,此时υ正(CH3OH)=υ逆(CH3OH),反应从在反应方向开始。
(1)根据图示可知:从3 min到9 min,CO2的浓度从0.5 mol/L变为0.25 mol/L,故用CO2浓度变化表示的反应速率v(CO2)=![]() =0.042 mol/(L·min);
=0.042 mol/(L·min);
(2)反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)在1 L的恒容密闭容器中进行,正反应是气体体积减小的反应,
CH3OH(g)+H2O(g)在1 L的恒容密闭容器中进行,正反应是气体体积减小的反应,
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点),由于CO2与CH3OH的浓度还在发生变化,说明反应未达到平衡,A不符合题意;
B.反应在恒容密闭容器中进行,若混合气体的压强不随时间的变化而变化,说明气体的物质的量不变,反应达到平衡状态,B符合题意;
C.单位时间内生成1 mol H2,就会消耗![]() mol CH3OH,同时生成1 mol CH3OH,说明反应正向进行,未达到平衡状态,C不符合题意;
mol CH3OH,同时生成1 mol CH3OH,说明反应正向进行,未达到平衡状态,C不符合题意;
D.气体的质量不比,混合气体的平均相对分子质量不随时间的变化而变化,说明气体的物质的量不变,反应达到平衡状态,D符合题意;
故合理选项是BD;
(3)根据图象可知:在反应开始时CO2浓度是1.00 mol/L,平衡时浓度为0.25 mol/L,所以CO2的平衡转化率=![]() ×100%=
×100%=![]() ×100%=75%;
×100%=75%;
(4)反应开始时加入1 mol CO2和3 mol H2,根据方程式CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)可知:CO2和H2反应消耗的物质的量的比是1:3,因此平衡时CO2(g)和H2(g)的物质的量的比也是1:3,所以平衡时m(CO2):m(H2)=(1 mol×44 g/mol):(3 mol×2 g/mol)=22:3;
CH3OH(g)+H2O(g)可知:CO2和H2反应消耗的物质的量的比是1:3,因此平衡时CO2(g)和H2(g)的物质的量的比也是1:3,所以平衡时m(CO2):m(H2)=(1 mol×44 g/mol):(3 mol×2 g/mol)=22:3;
(5)反应从正反应方向开始,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,当到第9 min时反应达到平衡,此时υ正(CH3OH)=υ逆(CH3OH),因此第3 min时υ正(CH3OH)>第9 min时υ逆(CH3OH)。