题目内容
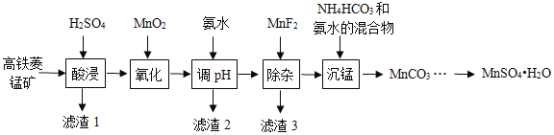
【题目】![]() 在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为
在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为![]() ,含有
,含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质)制备,部分工艺流程如图所示:
等杂质)制备,部分工艺流程如图所示:
相关金属离子生成氢氧化物沉淀的![]() (开始沉淀的
(开始沉淀的![]() 按离子浓度为
按离子浓度为![]() 计算):
计算):
金属离子 |
|
|
|
|
|
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“氧化”时发生反应的离子方程式为______________。
(2)“调![]() ”范围至5~6,得到滤渣2的主要成分除
”范围至5~6,得到滤渣2的主要成分除![]() 外还有_____________。
外还有_____________。
(3)“除杂”过程中加入![]() 的目的是______。
的目的是______。
(4)“沉锰”过程中发生反应的化学方程式为______。
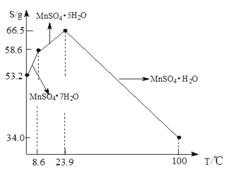
(5)![]() 在水中的溶解度与温度关系如图。由
在水中的溶解度与温度关系如图。由![]() 获得较纯净的
获得较纯净的![]() 晶体的方法是:将
晶体的方法是:将![]() 溶于适量的稀硫酸,控制温度在
溶于适量的稀硫酸,控制温度在![]() 之间蒸发结晶,______,得到
之间蒸发结晶,______,得到![]() 晶体,洗涤、烘干。晶体通常采用减压烘干的原因是______。
晶体,洗涤、烘干。晶体通常采用减压烘干的原因是______。
【答案】2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O ![]() 、
、![]() 除去Mg2+
除去Mg2+ ![]() 趁热过滤 防止
趁热过滤 防止![]() 失去结晶水
失去结晶水
【解析】
根据流程:高铁菱锰矿(主要成分为MnCO3,含有FeCO3、Al2O3、MgO、SiO2等杂质)加入硫酸酸浸,得到Mn2+、Fe2+、Al3+、Mg2+的酸性溶液,SiO2不溶,滤渣1为SiO2,向滤液加入MnO2,将二价铁离子氧化成三价铁,反应为:2FeSO4 +MnO2 +2H2SO4=Fe2(SO4)3 +MnSO4 +2H2O,氨水调节pH5~6沉淀Fe3+、Al3+,得到氢氧化铁和氢氧化铝的沉淀,滤渣2为多余的MnO2、Al(OH)3 Fe(OH)3,中加入MnF2除去Mg2+,滤渣3为MgF2,除杂后的溶液主要含有Mn2+,加入碳酸氢铵和氨水的混合物沉锰:Mn2++HCO3-+NH3H2O=MnCO3↓+NH4++H2O,将MnCO3溶于适量的稀硫酸,控制温度为90℃以上结晶,得到MnSO4H2O晶体,洗涤、烘干得到产品,以此解答该题。
(1)酸浸后,溶液中含有亚铁离子,能被二氧化锰氧化,得到三价铁离子和二价锰离子,故离子方程式为2Fe2+ +MnO2 +4H+=2Fe3+ +Mn2+ +2H2O;
(2)根据氢氧化物沉淀的 pH,“调pH”范围至5~6,得到滤渣2的主要成分除MnO2外还有Al(OH)3、Fe(OH)3;
(3)根据分析“除杂”过程中加入MnF2的目的是除去Mg2+;
(4)根据分析,除杂后的溶液主要含有Mn2+,加入碳酸氢铵和氨水的混合物沉锰:MnSO4+NH4HCO3+NH3H2O=MnCO3↓+(NH4)2SO4+H2O;
(5)由MnCO3获得较纯净的MnSO4H2O 晶体应先将MnCO3溶解,MnSO4在90℃析出MnSO4H2O,所以控制温度在![]() 之间蒸发结晶,并且要趁热过滤,得到MnSO4H2O晶体,洗涤、烘干得到产品,晶体通常采用减压烘干的原因是温度较低可防止MnSO4H2O失去结晶水。
之间蒸发结晶,并且要趁热过滤,得到MnSO4H2O晶体,洗涤、烘干得到产品,晶体通常采用减压烘干的原因是温度较低可防止MnSO4H2O失去结晶水。

 53随堂测系列答案
53随堂测系列答案【题目】重铬酸钾(K2Cr2O7)为用途极广的铬化合物,供制铬矾。火柴、铬颜料、并供鞣革、电镀、有机合成等用。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程如图所示:
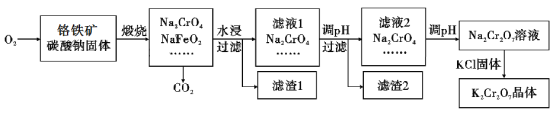
根据题意回答下列问题:
(1)锻烧时,铬铁矿发生复杂反应生成Na2CrO4和NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式是___。
(2)NaFeO2遇水强烈水解生成滤渣l的反应离子方程式是___。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7-8目的是___,滤液2调节pH约为5目的是___。
物质 | 溶解度/(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。此法能够制得K2Cr2O7晶体的原因是:___;为了从溶液中得到较多K2Cr2O7晶体的操作过程是:___、过滤、洗涤、干燥。将得到的K2Cr2O7晶体进一步纯化操作是:___。
(5)K2Cr2O7性质:往K2Cr2O7溶液中加入AgNO3溶液,生成一种砖红色沉淀、溶液的pH减小,反应离子方程式是___。
(6)K2Cr2O7产品含量测定:准确称取试样2.5g配成250mL溶液,用移液管吸取25.00mL溶液放入碘量瓶,加入10mL2mol/L硫酸、2gKI于暗处5min,另加100mL水,用0.2000mol/L Na2S2O3标准液滴定至溶液黄绿色,再加3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。平行三次实验,平均消耗Na2S2O3标准液的体积25.00mL。K2Cr2O7产品的纯度为___。
有关反应如下:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O
2Na2S2O3+I2=Na2S4O6+2NaI