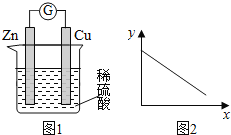
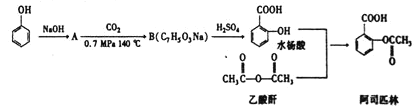
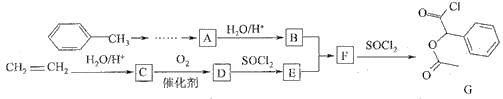
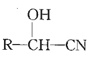Ő‚ńŅńŕ»›
°ĺŐ‚ńŅ°ŅĽūĶÁ≥ß∑Ř√ļĽ“Ķń÷ų“™≥…∑÷ő™SiO2°ĘAl2O3°ĘFeO°ĘFe2O3°ĘMgO°ĘTiO2Ķ»°£ń≥—–ĺŅ–°◊ť∂‘∆šĹÝ––◊ŘļŌī¶ņŪĶńŃų≥Ő»ÁÕľňý ĺ£ļ

“—÷™£ļĘŔ°įňŠĹĢ°ĪļůÓ—÷ų“™“‘TiOSO4Ķń–ő Ĺīś‘ŕ£¨«ŅĶÁĹ‚÷ TiOSO4‘໋“ļ÷–ĹŲń‹ĶÁņŽ≥ŲSO42-ļÕTiO2+£¨TiO2+‘ŕ80°ś◊ů”“ňģĹ‚…ķ≥…TiO2°§xH2O°£
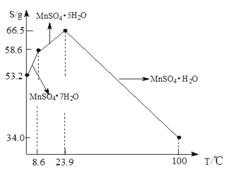
Ęŕ“—÷™FeSO4‘ŕ≤ĽÕ¨ő¬∂»Ō¬Ķń»‹Ĺ‚∂»ļÕőŲ≥ŲĺßŐŚĶń◊ť≥…»ÁŌ¬ĪŪ£ļ

ĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©ľ”Ņž°įňŠĹĢ°ĪňŔ¬ ĶńīŽ ©”–ńń–©£Ņ–ī≥Ų“ĽŐűľīŅ…___£¨¬ň‘Ł1Ķń÷ų“™≥…∑÷ő™___(ŐÓĽĮ—ß Ĺ)°£
£®2£©°į∑ī”¶°Ī Īľ”»ŽŐķ∑ŘĶń◊ų”√ő™___£®”√ņŽ◊”∑Ĺ≥Ő ĹĪŪ ĺ£©°£
£®3£©°įĹŠĺß°Ī Ī£¨»Ű“™ĽŮĶ√FeSO4°§7H2O£¨‘Ú∂‘»‹“ļĹÝ––Ķń≤Ŕ◊ų «£ļ’Ű∑ĘŇ®ňű£¨___£¨Ļż¬ň£¨ŌīĶ”£¨ł…‘Ô°£
£®4£©°įňģĹ‚°Ī∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™____°£
£®5£© Ķ—ť “”√MgCl2°§6H2O÷∆ĪłMgCl2ĻŐŐŚ£¨‘ŕľ”»»ĶńÕ¨ Ī“™≤Ľ∂ŌÕ®»Ž___(ŐÓĽĮ—ß Ĺ£¨Ō¬Õ¨)»Ű≤ĽÕ®»Žł√őÔ÷ £¨◊Ó÷’Ķ√ĶĹĶń≤ķőÔ÷–Ņ…ń‹ļ¨”–___°£
°ĺīūįł°ŅőĘ»»£®ĽÚĹę√ļĽ“∑Ň»Ž Į»ř√ř÷–£© SiO2 2Fe3++Fe=3Fe2+ ņš»īĶĹ50°ś“‘Ō¬ĹŠĺß TiO2++(x+1)H2O![]() TiO2°§xH2O+2H+ HCl MgOĽÚMg£®OH£©Cl
TiO2°§xH2O+2H+ HCl MgOĽÚMg£®OH£©Cl
°ĺĹ‚őŲ°Ņ
∑Ř√ļĽ“Ķń÷ų“™≥…∑÷ő™SiO2°ĘAl2O3°ĘFeO°ĘFe2O3°ĘMgO°ĘTiO2Ķ»£¨ľ”»ŽŃÚňŠňŠ»‹Ļż¬ňĶ√ĶŬň‘Ł1ļÕ¬ň“ļ£¨—űĽĮ¬Ń»‹Ĺ‚…ķ≥…ŃÚňŠ¬Ń£¨—űĽĮ—«Őķ»‹Ĺ‚…ķ≥…ŃÚňŠ—«Őķ£¨—űĽĮŐķ»‹Ĺ‚…ķ≥…ŃÚňŠŐķ£¨—űĽĮ√廋ł…ķ≥…ŃÚňŠ√ĺ£¨°įňŠĹĢ°ĪļůÓ—÷ų“™“‘TiOSO4–ő Ĺīś‘ŕ£¨¬ň‘Łő™SiO2£¨ľ”»ŽŐķ∑ŘĽĻ‘≠ŐķņŽ◊”…ķ≥…—«ŐķņŽ◊”£¨ĹŠĺßőŲ≥ŲŃÚňŠ—«ŐķĺßŐŚ£¨Ļż¬ň£¨Ķ√ĶŬň“ļ1ļ¨ŃÚňŠ¬Ń°ĘŃÚňŠ√ĺ°ĘTiOSO4°Ę…ŔŃŅŃÚňŠ—«Őķ£¨ňģĹ‚Ļż¬ň£¨TiOSO4…ķ≥…TiO2xH2O£¨ĺ≠ňŠŌīňģŌīł…‘ÔļÕ◊∆…’ļůĶ√ĶĹTiO2£¨¬ň“ļ2÷–ļ¨ŃÚňŠ¬ŃļÕŃÚňŠ√ĺ°Ę…ŔŃŅŃÚňŠ—«Őķ£¨ľ”»ŽĻż—űĽĮ«‚—űĽĮ—«ŐķņŽ◊”ő™ŐķņŽ◊”£¨ĶųĹ໋“ļpH Ļ¬ŃņŽ◊”ļÕŐķņŽ◊”»ę≤Ņ≥ŃĶŪ£¨Ļż¬ňĶ√ĶŬň‘Ł2ő™«‚—űĽĮŐķļÕ«‚—űĽĮ¬Ń≥ŃĶŪ£¨¬ň“ļ3ļ¨ŃÚňŠ√ĺ£¨ĺ›īň∑÷őŲ°£
£®1£©ł√∑ī”¶ő™ĻŐ“ļ∑ī”¶£¨»Ű“™ľ”Ņž°įňŠĹĢ°ĪĶńňŔ¬ £¨Ņ…Õ®Ļżľ”»»ŐŠłŖĽĮ—ß∑ī”¶ňŔ¬ £¨“≤Ņ…Ĺę√ļĽ“∑Ň»Ž Į»ř√ř÷–£¨‘Ųīů∑ī”¶Ĺ”ī•√śĽż£¨ŐŠłŖĽĮ—ß∑ī”¶ňŔ¬ £Ľ”……Ō Ų∑÷őŲŅ…÷™£¨¬ň‘Ł÷ų“™ő™SiO2£Ľ
£®2£©“Ú–Ť“™ĹęFe3+◊™ĽĮő™Fe2+“‘FeSO4°§7H2OĹŠĺß≥ż»•£¨Ļ ľ”»ŽŐķ∑ŘĶńńŅĶń «Ĺ껿ľŘŐķ◊™ĽĮő™∂ĢľŘŐķ£¨∆šņŽ◊”∑ī”¶∑Ĺ≥Ő Ĺő™£ļ2Fe3++Fe=3Fe2+£Ľ
£®3£©”…Ő‚ł…ĪŪłŮŅ…÷™£¨FeSO4‘ŕ50°ś“‘Ō¬÷ų“™őŲ≥ŲĺßŐŚő™FeSO4°§7H2O£¨»Ű“™ĽŮĶ√FeSO4°§7H2O£¨‘Ú∂‘»‹“ļĹÝ––Ķń≤Ŕ◊ų «£ļ’Ű∑ĘŇ®ňű£¨ņš»īĶĹ50°ś“‘Ō¬ĹŠĺߣ¨Ļż¬ň£¨ŌīĶ”£¨ł…‘Ô£Ľ
£®4£©ňģĹ‚Ļż≥Ő÷–£¨TiOSO4…ķ≥…TiO2xH2O£¨“Ú°į«ŅĶÁĹ‚÷ TiOSO4‘໋“ļ÷–ĹŲń‹ĶÁņŽ≥ŲSO42-ļÕTiO2+£¨TiO2+‘ŕ80°ś◊ů”“ňģĹ‚…ķ≥…TiO2°§xH2O°Ī£¨Ļ ł√∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™£ļTiO2++(x+1)H2O![]() TiO2°§xH2O+2H+£Ľ
TiO2°§xH2O+2H+£Ľ
£®5£©MgCl2°§6H2O÷∆ĪłMgCl2ĻŐŐŚ£¨‘ŕľ”»»Ļż≥Ő÷–£¨MgCl2÷–Mg2+ňģĹ‚≥Ő∂»‘Ųīů£¨…ķ≥…ĶńHClňś◊ŇŇ®∂»‘Ųľ”ĽŠ“Á≥Ų£¨Ķľ÷¬◊Ó÷’ňýĶ√ĻŐŐŚ÷–ļ¨”–MgOĽÚMg(OH)Cl£¨“Úīň‘ŕľ”»»ĶńÕ¨ Ī“™≤Ľ∂ŌÕ®»ŽHCl∆ÝŐŚ£¨“‘īň“÷÷∆MgCl2ĶńňģĹ‚£¨ī”∂ÝĽŮĶ√MgCl2ĻŐŐŚ°£

 ŐžŐžŌÚ…Ō“ĽĪĺļ√ĺŪŌĶŃ–īūįł
ŐžŐžŌÚ…Ō“ĽĪĺļ√ĺŪŌĶŃ–īūįł –°—ß…ķ10∑÷÷””¶”√Ő‚ŌĶŃ–īūįł
–°—ß…ķ10∑÷÷””¶”√Ő‚ŌĶŃ–īūįł°ĺŐ‚ńŅ°Ņ![]() ‘ŕĻ§“Ķ°ĘŇ©“ĶĶ»∑Ĺ√ś”–Ļ„∑ļĶń”¶”√£¨Ļ§“Ķ…ŌŅ…”…łŖŐķŃ‚√ŐŅů£®÷ų“™≥…∑÷ő™
‘ŕĻ§“Ķ°ĘŇ©“ĶĶ»∑Ĺ√ś”–Ļ„∑ļĶń”¶”√£¨Ļ§“Ķ…ŌŅ…”…łŖŐķŃ‚√ŐŅů£®÷ų“™≥…∑÷ő™![]() £¨ļ¨”–
£¨ļ¨”–![]() °Ę
°Ę![]() °Ę
°Ę![]() °Ę
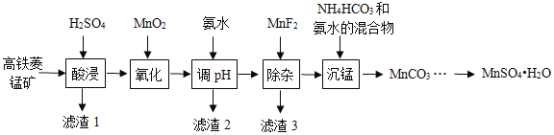
°Ę![]() Ķ»‘”÷ £©÷∆Īł£¨≤Ņ∑÷Ļ§“’Ńų≥Ő»ÁÕľňý ĺ£ļ
Ķ»‘”÷ £©÷∆Īł£¨≤Ņ∑÷Ļ§“’Ńų≥Ő»ÁÕľňý ĺ£ļ
ŌŗĻōĹū ŰņŽ◊”…ķ≥…«‚—űĽĮőÔ≥ŃĶŪĶń![]() £®Ņ™ ľ≥ŃĶŪĶń
£®Ņ™ ľ≥ŃĶŪĶń![]() įīņŽ◊”Ň®∂»ő™
įīņŽ◊”Ň®∂»ő™![]() ľ∆ň„£©£ļ
ľ∆ň„£©£ļ
Ĺū ŰņŽ◊” |
|
|
|
|
|
Ņ™ ľ≥ŃĶŪĶń | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
≥ŃĶŪÕÍ»ęĶń | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
£®1£©°į—űĽĮ°Ī Ī∑Ę…ķ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™______________°£
£®2£©°įĶų![]() °Ī∑∂őß÷Ń5°ę6£¨Ķ√ĶŬň‘Ł2Ķń÷ų“™≥…∑÷≥ż
°Ī∑∂őß÷Ń5°ę6£¨Ķ√ĶŬň‘Ł2Ķń÷ų“™≥…∑÷≥ż![]() Õ‚ĽĻ”–_____________°£
Õ‚ĽĻ”–_____________°£
£®3£©°į≥ż‘”°ĪĻż≥Ő÷–ľ”»Ž![]() ĶńńŅĶń «______°£
ĶńńŅĶń «______°£
£®4£©°į≥Ń√Ő°ĪĻż≥Ő÷–∑Ę…ķ∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺő™______°£
£®5£©![]() ‘ŕňģ÷–Ķń»‹Ĺ‚∂»”Žő¬∂»ĻōŌĶ»ÁÕľ°£”…
‘ŕňģ÷–Ķń»‹Ĺ‚∂»”Žő¬∂»ĻōŌĶ»ÁÕľ°£”…![]() ĽŮĶ√ĹŌīŅĺĽĶń
ĽŮĶ√ĹŌīŅĺĽĶń![]() ĺßŐŚĶń∑Ĺ∑® «£ļĹę
ĺßŐŚĶń∑Ĺ∑® «£ļĹę![]() »‹”ŕ ŃŅĶńŌ°ŃÚňŠ£¨Ņō÷∆ő¬∂»‘ŕ
»‹”ŕ ŃŅĶńŌ°ŃÚňŠ£¨Ņō÷∆ő¬∂»‘ŕ![]() ÷ģľš’Ű∑ĘĹŠĺߣ¨______£¨Ķ√ĶĹ
÷ģľš’Ű∑ĘĹŠĺߣ¨______£¨Ķ√ĶĹ![]() ĺßŐŚ£¨ŌīĶ”°Ęļśł…°£ĺßŐŚÕ®≥£≤…”√ľű—Ļļśł…Ķń‘≠“Ú «______°£
ĺßŐŚ£¨ŌīĶ”°Ęļśł…°£ĺßŐŚÕ®≥£≤…”√ľű—Ļļśł…Ķń‘≠“Ú «______°£