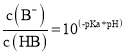题目内容
【题目】重铬酸钾(K2Cr2O7)为用途极广的铬化合物,供制铬矾。火柴、铬颜料、并供鞣革、电镀、有机合成等用。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程如图所示:
根据题意回答下列问题:
(1)锻烧时,铬铁矿发生复杂反应生成Na2CrO4和NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式是___。
(2)NaFeO2遇水强烈水解生成滤渣l的反应离子方程式是___。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7-8目的是___,滤液2调节pH约为5目的是___。
物质 | 溶解度/(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。此法能够制得K2Cr2O7晶体的原因是:___;为了从溶液中得到较多K2Cr2O7晶体的操作过程是:___、过滤、洗涤、干燥。将得到的K2Cr2O7晶体进一步纯化操作是:___。
(5)K2Cr2O7性质:往K2Cr2O7溶液中加入AgNO3溶液,生成一种砖红色沉淀、溶液的pH减小,反应离子方程式是___。
(6)K2Cr2O7产品含量测定:准确称取试样2.5g配成250mL溶液,用移液管吸取25.00mL溶液放入碘量瓶,加入10mL2mol/L硫酸、2gKI于暗处5min,另加100mL水,用0.2000mol/L Na2S2O3标准液滴定至溶液黄绿色,再加3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。平行三次实验,平均消耗Na2S2O3标准液的体积25.00mL。K2Cr2O7产品的纯度为___。
有关反应如下:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O
2Na2S2O3+I2=Na2S4O6+2NaI
【答案】![]() NaFeO2+2H2O=NaOH+ Fe(OH)3↓ NaAlO2、Na2SiO3转化为H2SiO3、Al(OH)3除去 Na2CrO4在酸性条件下可转化为Na2Cr2O7 同温度下K2Cr2O7晶体的溶解度小于Na2Cr2O7,冷却时会结晶析出 加热浓缩、降温结晶 重结晶
NaFeO2+2H2O=NaOH+ Fe(OH)3↓ NaAlO2、Na2SiO3转化为H2SiO3、Al(OH)3除去 Na2CrO4在酸性条件下可转化为Na2Cr2O7 同温度下K2Cr2O7晶体的溶解度小于Na2Cr2O7,冷却时会结晶析出 加热浓缩、降温结晶 重结晶 ![]() 98%
98%
【解析】
由流程可知,焙烧时发生反应铬铁矿的主要成分可表示为FeOCr2O3,还含有SiO2、Al2O3、Fe2O3等杂质,将铬铁矿和碳酸钠、氧气混合焙烧,发生反应4FeOCr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2、Na2CO3+Al2O3=2NaAlO2+CO2↑、Na2CO3+SiO2=Na2SiO3+CO2↑,然后水浸时发生NaFeO2+2H2O=NaOH+Fe(OH)3↓,过滤得到滤渣1和滤液1,K2Cr2O7有强氧化性可知,滤液1中主要是NaAlO2、Na2SiO3、Na2CrO4、NaOH,滤渣1为Fe(OH)3;将滤液1中调节pH使NaAlO2、Na2SiO3反应生成H2SiO3、Al(OH)3,滤渣2是H2SiO3、Al (OH)3,滤液2主要是Na2CrO4,调节pH值酸性,溶质变为Na2Cr2O7,然后加入硫酸钾固体,因为Na2Cr2O7的溶解度大于K2Cr2O7,所以得到K2Cr2O7晶体,采用过滤方法得到K2Cr2O7晶体,以此来解答。
(1)根据题目信息可知Al2O3与Na2CO3反应生成NaAlO2,
故答案为:![]() ;
;
(2)根据分析可知滤渣1为Fe(OH)3,故答案为:NaFeO2+2H2O=NaOH+ Fe(OH)3↓;
(3)滤液1中调节pH可使NaAlO2、Na2SiO3反应生成H2SiO3、Al(OH)3,到达除杂目的,酸性条件下Na2CrO4可转化为Na2Cr2O7;
故答案为:NaAlO2、Na2SiO3转化为H2SiO3、Al(OH)3除去;Na2CrO4在酸性条件下可转化为Na2Cr2O7;
(4)根据表格可知同温度下K2Cr2O7晶体的溶解度小于Na2Cr2O7,Na2Cr2O7;溶液中加入KCl固体可发生复分解反应;K2Cr2O7晶体的溶解度受温度影响大,杂质能溶于水,溶液中得到较多晶体的操作是加热浓缩、降温结晶、过滤、洗涤、干燥;K2Cr2O7晶体进一步纯化操作是重结晶,
故答案为:同温度下K2Cr2O7晶体的溶解度小于Na2Cr2O7,冷却时会结晶析出;加热浓缩、降温结晶;重结晶;
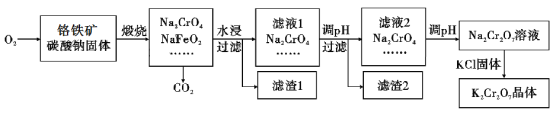
(5)根据题目信息和反应物通过元素守恒可知离子方程式为:![]() ;
;
(6)根据所给的两个方程式可到物质间的数量关系为:K2Cr2O7~3 I2~6 Na2S2O3,n(Na2S2O3)=(0.2000×25×10-3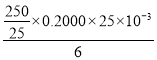 =
=![]() mol,则纯度为
mol,则纯度为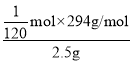 =98%;
=98%;
故答案为:98%。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】![]() 在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为
在工业、农业等方面有广泛的应用,工业上可由高铁菱锰矿(主要成分为![]() ,含有
,含有![]() 、
、![]() 、
、![]() 、
、![]() 等杂质)制备,部分工艺流程如图所示:
等杂质)制备,部分工艺流程如图所示:

相关金属离子生成氢氧化物沉淀的![]() (开始沉淀的
(开始沉淀的![]() 按离子浓度为
按离子浓度为![]() 计算):
计算):
金属离子 |
|
|
|
|
|
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“氧化”时发生反应的离子方程式为______________。
(2)“调![]() ”范围至5~6,得到滤渣2的主要成分除
”范围至5~6,得到滤渣2的主要成分除![]() 外还有_____________。
外还有_____________。
(3)“除杂”过程中加入![]() 的目的是______。
的目的是______。
(4)“沉锰”过程中发生反应的化学方程式为______。
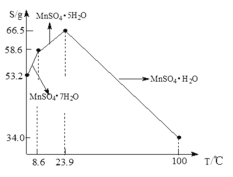
(5)![]() 在水中的溶解度与温度关系如图。由
在水中的溶解度与温度关系如图。由![]() 获得较纯净的
获得较纯净的![]() 晶体的方法是:将
晶体的方法是:将![]() 溶于适量的稀硫酸,控制温度在
溶于适量的稀硫酸,控制温度在![]() 之间蒸发结晶,______,得到
之间蒸发结晶,______,得到![]() 晶体,洗涤、烘干。晶体通常采用减压烘干的原因是______。
晶体,洗涤、烘干。晶体通常采用减压烘干的原因是______。