题目内容
【题目】下图为生锈了的家用铁锅,下列有关解释事实的方程式不正确的是

A. 铁锅生锈过程中有原电池反应,负极反应式是:Fe—2e—= Fe2+
B. 铁锅生锈过程中有 Fe(OH)3生成:Fe3+ + 3H2O![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. 摄入体内的铁锈会在胃内产生不利于健康的Fe3+:Fe2O3 + 6H+=2Fe3++3H2O
D. 用醋可除去铁锈:6CH3COOH + Fe2O3 =6CH3COO—+ 2Fe3+ + 3H2O
【答案】B
【解析】A、铁锅生锈过程属于原电池,属于吸氧腐蚀,负极反应式为Fe-2e-=Fe2+,故A说法正确;B、铁锅生锈的过程是:负极反应式为Fe-2e-=Fe2+,正极反应式为O2+2H2O+4e-=4OH-,即电池总反应式为2Fe+O2+2H2O=2Fe(OH)2,Fe(OH)2被空气中氧气氧化成Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故B说法错误;C、胃酸的成分是盐酸,铁锈是Fe2O3,属于碱性氧化物,发生Fe2O3+6H+=2Fe3++3H2O,故C说法正确;D、醋中含有醋酸,与Fe2O3发生:6CH3COOH + Fe2O3 =6CH3COO-+ 2Fe3+ + 3H2O,故D说法正确。

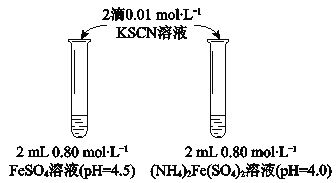
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________。
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________,原因是__________________。
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________。
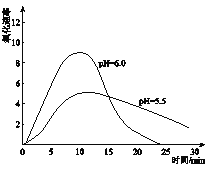
(6)综合以上实验,增强Fe2+稳定性的措施有_________________。