题目内容
【题目】元素化合物知识是高中化学的基础。H、Na、Mg、Ca、Al、Cr、Cu、Br、Cl等是中学化学中常见的元素,请根据题意回答与这些元素有关的问题。
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为______;CuSO4粉末常用来检验一些有机物中的微量水分,若含有微量水分则会看到的现象是______。
(2)单质镁在空气中燃烧的主要产物是白色的_______(填化学式),还生成少量的______(填化学式)。金属镁还可以与卤素反应,生成的MgI2中 Mg2+与I-间的作用力______MgF2 中 Mg2+与 F-间的作用力(填“>”、“<”或“=”)。
(3)Ca元素与 H 元素组成的物质为_____________(填“共价”或“离子”)化合物,该物质可以与水反应,产生的气体可作为野外工作的应急燃料,该反应的化学方程式为______。
(4)硬脂酸钠(C17H35COONa)是肥皂的主要成分, 主要用于制造皂类洗涤剂、 化妆品的乳化剂等。鉴别硬脂酸钠(C17H35COONa)与硬脂酸钾(C17H35COOK)可采用的实验方法和现象分别是____________。
(5)已知元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH) 4- (绿色)、Cr2O72- (橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3 为难溶于水的灰蓝色固体。Cr3+与 Al3+的化学性质相似,在Cr2(SO4)3 溶液中逐滴加入NaOH 溶液直至过量,可观察到的现象是______。
(6)溴与氯能以共价键结合形成 BrCl。 BrCl 分子中,______显正电性。已知 BrCl 可以与水发生反应,且该反应为非氧化还原反应,则该反应的化学方程式为______。
【答案】 Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 固体吸水后颜色由白色变为蓝色 MgO Mg3N2 < 离子 CaH2 + 2H2O = Ca(OH)2 + 2H2↑ 分别取样进行焰色反应 钠盐焰色为黄色,钾盐焰色为紫色(透过蓝色钴玻璃) 蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液 Br(或溴) BrCl+H2O=HCl+HBrO
CuSO4+SO2↑+2H2O 固体吸水后颜色由白色变为蓝色 MgO Mg3N2 < 离子 CaH2 + 2H2O = Ca(OH)2 + 2H2↑ 分别取样进行焰色反应 钠盐焰色为黄色,钾盐焰色为紫色(透过蓝色钴玻璃) 蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液 Br(或溴) BrCl+H2O=HCl+HBrO
【解析】 (1)铜和浓硫酸在加热条件下反应生成硫酸铜和二氧化硫;水和硫酸铜粉末形成蓝色的CuSO4![]() 5H2O晶体;(2)镁在空气中的燃烧产物有氧化镁和氮化镁;能量越低越稳定,越稳定的物质内部化学键键能越大;(3)由阴阳离子形成的化合物是离子化合物;(4)利用焰色反应鉴别Na和K元素;(5)Cr3+与 Al3+的化学性质相似,Cr(OH)3 先沉淀后溶解;(6)氯的非金属性比溴强;正电性的原子或原子团结合OH形成分子,则生成HBrO。
5H2O晶体;(2)镁在空气中的燃烧产物有氧化镁和氮化镁;能量越低越稳定,越稳定的物质内部化学键键能越大;(3)由阴阳离子形成的化合物是离子化合物;(4)利用焰色反应鉴别Na和K元素;(5)Cr3+与 Al3+的化学性质相似,Cr(OH)3 先沉淀后溶解;(6)氯的非金属性比溴强;正电性的原子或原子团结合OH形成分子,则生成HBrO。
(1) 铜和浓硫酸在加热条件下反应生成硫酸铜和二氧化硫,反应的化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;水和硫酸铜粉末形成蓝色的CuSO4
CuSO4+SO2↑+2H2O;水和硫酸铜粉末形成蓝色的CuSO4![]() 5H2O晶体,若含有微量水分则会看到的现象是固体吸水后颜色由白色变为蓝色。故答案为:Cu+2H2SO4(浓)
5H2O晶体,若含有微量水分则会看到的现象是固体吸水后颜色由白色变为蓝色。故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O ;固体吸水后颜色由白色变为蓝色。
CuSO4+SO2↑+2H2O ;固体吸水后颜色由白色变为蓝色。
(2)单质镁在空气中燃烧的主要产物是白色的MgO,还生成少量的Mg3N2;能量越低越稳定,越稳定的物质内部化学键键能越大,MgI2中 Mg2+与I-间的作用力< MgF2 中 Mg2+与 F-间的作用力。故答案为:MgO ; Mg3N2 ;<。
(3) 由阴阳离子形成的化合物是离子化合物,CaH 含有Ca2+和H-为离子化合物,根据信息CaH与水反应,产生的气体可作为野外工作的应急燃料,反应的化学方程式为CaH2 + 2H2O = Ca(OH)2 + 2H2↑。故答案为:离子 ;CaH2 + 2H2O = Ca(OH)2 + 2H2↑。
(4) 鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法和现象分别是焰色反应,观察到黄色的为硬脂酸钠、紫色的为硬脂酸钾,故答案为:焰色反应,观察到黄色的为硬脂酸钠、紫色的为硬脂酸钾;
(5) Cr3+与 Al3+的化学性质相似,根据信息,Cr2(SO4)3 溶液中逐滴加入NaOH 溶液直至过量先生成Cr(OH)3 的灰蓝色固体,然后沉淀逐渐溶解形成绿色溶液,可观察到的现象是蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液。故答案为:蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液。
(6) 氯的非金属性比溴强,BrCl 中共用电子对偏向Cl,偏离Br,Br显正电性。BrCl 与水发生反应,且为非氧化还原反应,正电性的原子或原子团结合OH形成分子,则生成HBrO。则该反应的化学方程式为BrCl+H2O=HCl+HBrO。故答案为:Br(或溴) ;BrCl+H2O=HCl+HBrO。

【题目】CO是生产羰基化学品的基本原料,对于以水煤气为原料提取CO的工艺,如果氢气
未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题.反应CO(g)+H2O (g)H2(g)+CO2(g)的平衡常数随温度的变化如表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | a |
(1)上述反应的逆反应是(填“放热”或“吸热”)反应.
(2)已知在一定温度下:C(s)+CO2(g)2CO(g) K
C(s)+H2O (g)H2(g)+CO(g) K1
CO(g)+H2O (g)H2(g)+CO2(g) K2
则K、K1、K2、之间的关系是 .
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O (g)H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.
①0~4min内,CO2的平均反应速率为molL﹣1min﹣1 , 800℃时a= .
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(molL﹣1)如表,其中达到平衡状态的是(填字母).
A | B | C | D | |
c(CO2) | 3 | 1 | 0.8 | 1 |
c(H2) | 2 | 1 | 0.8 | 1 |
c(CO) | 1 | 2 | 3 | 0.5 |
c(H2O) | 2 | 2 | 3 | 2 |
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
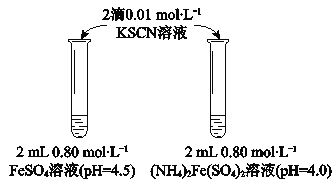
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________。
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________,原因是__________________。
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________。
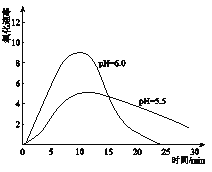
(6)综合以上实验,增强Fe2+稳定性的措施有_________________。
