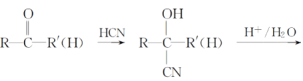
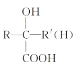题目内容
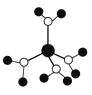
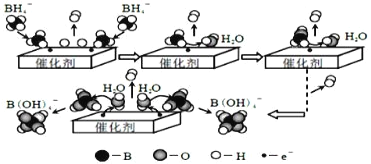
【题目】硼氢化钠(NaBH4)在工业生产中应用广泛。它在催化剂作用下与水反应获取氢气的微观过程如图所示。下列说法正确的是( )
A.水在此过程中作还原剂
B.若将NaBH4中的H用D代替,反应后生成的气体中含有H2、HD和D2
C.催化剂可以加快反应速率,其用量多少不影响反应速率
D.NaBH4与水反应的离子方程式为:BH4-+4H2O=B(OH)4-+4H2↑
【答案】BD
【解析】
根据硼氢化钠(NaBH4)在催化剂作用下与水反应获取氢气的微观过程图可知,BH4-和H2O生成B(OH)4-和H2,离子反应方程式为:BH4-+4H2O===B(OH)4-+4H2↑,由此分析解答。
A.H2O变成H2,水中氢元素的化合价降低,是氧化剂,A选项错误;
B.若用D代替H,生成的氢气原子重新组合,所以生成的氢气有H2、HD、D2,B选项正确;
C.使用催化剂可以改变化学反应速率,所以通过控制催化剂的用量和表面积,可以控制氢气的产生速率,一定范围内,催化剂的用量多少也会影响反应速率,C选项错误;
D.根据上述分析,反应的离子方程式为:BH4-+4H2O=B(OH)4-+4H2↑,D选项正确;
答案选BD。

【题目】由几种离子化合物组成的混合物中含有以下离子中的若干种:K+、Cl-、NH![]() 、Mg2+、Ba2+、CO
、Mg2+、Ba2+、CO![]() 、SO
、SO![]() 。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验。
。将该混合物溶于水后得澄清溶液,现取三份100 mL该溶液分别进行如下实验。
实验序号 | 实验内容 | 实验结果 |
1 | 加入AgNO3溶液 | 有白色沉淀生成 |
2 | 加入足量NaOH溶液并加热 | 收集到气体1.12 L(标准状况下) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后过滤、洗涤、干燥、称量 | 第一次称量读数为6.27 g,第二次称量读数为2.33 g |
请回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断原混合物中一定不存在的离子是________。
(2)试确定100 mL溶液中一定存在的阴离子及其物质的量浓度(可不填满)。
阴离子符号 | 物质的量浓度(mol·L-1) |
_______ | ___________ |
______ | _______________ |
(3)K+是否存在?________(填“存在”或“不存在”),判断的理由是____________________。
【题目】室温下,1 L含0.1 mol HA和0.1 mol NaA的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
溶液a | 通入0.01 mol HCl | 加入0.01 mol NaOH | |
pH | 4.76 | 4.67 | 4.85 |
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法正确的是
A.溶液a和 0.1 mol·L1 HA溶液中H2O的电离程度前者小于后者
B.向溶液a中通入0.1 mol HCl时,A结合H+生成 HA,pH变化不大
C.该温度下HA的Ka=10-4.76
D.含0.1 mol·L1 Na2HPO4 与0.1 mol·L1 NaH2PO4的混合溶液也可做缓冲溶液