题目内容
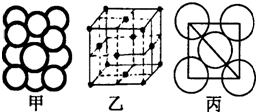 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.已知:
A原子的核外电子数与电子层数相等;
B元素原子的核外P电子数比S电子数少l个;
C原子的第一至第四电离能为:I1=738kJ/mol,I2=1451kJ/mol,I3=7733kJ/mol,I4=10540kJ/mol;
D原子核外所有P轨道为全充满或半充满;
E元素的族序数与周期序数的差为4;
(1)写出E元索在周期表位置:
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为:
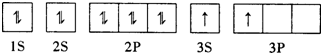
该同学所画的轨道式违背了
(3)已知BA5为离子化合物,写出其电子式:
(4)DE3中心原子杂化方式为
(5)某金属晶体中原子堆积方式如图甲,晶胞特征如图乙,原子相对位置关系如图丙;则晶胞中该原子配位数为
(已知该金属相对原子质量为m,原子半径为a cm)
分析:A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素,则F为K元素;A原子的核外电子数与电子层数相等,则A为H元素;B元素原子的核外P电子数比S电子数少l个,B有2个电子层,为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素,据此解答.
解答:解:A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素,则F为K元素;A原子的核外电子数与电子层数相等,则A为H元素;B元素原子的核外P电子数比S电子数少l个,B有2个电子层,为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素,
(1)E为Cl元素,在周期表位置:第三周期第ⅦA族;D为P元素,原子的核外电子排布式:1s22s22p63s23p3,
故答案为:第三周期第ⅦA族;1s22s22p63s23p3;
(2某同学根据上述信息,推断C基态原子的核外电子排布为 ,该同学所画的电子排布图中3s能级为填充满,就填充能量更高的3p能级,违背了能量最低原理,
,该同学所画的电子排布图中3s能级为填充满,就填充能量更高的3p能级,违背了能量最低原理,
故答案为:能量最低原理;
(3)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为 ,
,
故答案为: ;
;
(4)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥形,
故答案为:sp3,三角锥形;
(5)由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子处在12个面上,故配位数为12;
晶胞中原子数目为6×
+8×
=4,原子半径为acm,则晶胞中原子总体积=4×
πa3 cm3,由图丙可知,正方形对角线长度为4a cm,故立方体的棱长为
×4a cm=2
a cm,晶胞体积为(2
a cm)3=16
a3 cm3,故空间利用率为
×100%=74%;
该金属相对原子质量为m,则晶胞的质量=4×
g,故晶体的密度=
=
g/cm3,
故答案为:12;74%;
g/cm3.
(1)E为Cl元素,在周期表位置:第三周期第ⅦA族;D为P元素,原子的核外电子排布式:1s22s22p63s23p3,
故答案为:第三周期第ⅦA族;1s22s22p63s23p3;
(2某同学根据上述信息,推断C基态原子的核外电子排布为
 ,该同学所画的电子排布图中3s能级为填充满,就填充能量更高的3p能级,违背了能量最低原理,
,该同学所画的电子排布图中3s能级为填充满,就填充能量更高的3p能级,违背了能量最低原理,故答案为:能量最低原理;
(3)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为
 ,
,故答案为:
 ;
;(4)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥形,
故答案为:sp3,三角锥形;
(5)由图可知,晶胞为面心立方堆积,以顶点的原子分析,位于面心的原子与之相邻,1个顶点原子处在12个面上,故配位数为12;
晶胞中原子数目为6×
| 1 |
| 2 |
| 1 |
| 8 |
| 4 |
| 3 |
| ||
| 2 |
| 2 |
| 2 |
| 2 |
4×
| ||
16
|
该金属相对原子质量为m,则晶胞的质量=4×
| m |
| NA |
4×
| ||
16
|
| ||
| 8a3?NA |
故答案为:12;74%;
| ||
| 8a3?NA |
点评:本题考查物质结构与性质,涉及结构性质与位置关系、核外电子排布规律、电子式、杂化轨道理论、分子结构、晶胞计算等,综合性较大,难度中等,推断元素是解题的关键,(5)为易错点、难点,需要学生具有较好的数学计算能力与空间想象力,注意基础知识的掌握.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.