题目内容
20.某同学按图所示的装置进行电解实验.下列说法正确的是( )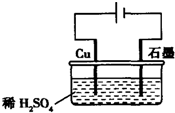
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主要反应方程式为:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一定时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度不断增大 |
分析 由图中装置可知,装置是电解池,铜和电源正极连接座电解池阳极,铜本身失电子生成铜离子;石墨解电源负极做电解池的阴极,溶液中氢离子得到电子生成氢气;溶液中铜离子和氢氧根离子结合生成氢氧化铜沉淀.
解答 解:A、电解过程中,铜电极是活性电极,铜失电子生成铜离子,故A错误;
B、电解初期,阳极电极反应为Cu-2e-=Cu2+;阴极电极反应为:2H++2e-=H2↑,所以反应初期发生的反应为Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑,故B正确;
C、电解一定时间后,溶液中铜离子移向阴极优先放电生成铜,所以电解一定时间后,石墨电极上有铜析出,故C正确;
D、电解过程中氢离子不断放电生成氢气,浓度减小,故D错误;
故选BC.
点评 本题考查了电解原理的原理应用,电极反应,电极判断,电极名称是解题关键,题目难度中等.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
11. 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:
(1)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10.处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)<c(HCN)(填“>”、“<”或“=”).
(2)已知:
①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)═Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g).下表为该反应在不同温度时的平衡常数.
该反应的△H<0(填“>”、“<”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为75%.
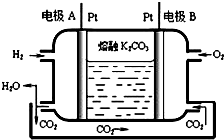
(7)一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:(1)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10.处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)<c(HCN)(填“>”、“<”或“=”).
(2)已知:
①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)═Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g).下表为该反应在不同温度时的平衡常数.
| 温度/ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(7)一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
8.已知C-C单键可以绕键轴旋转,某烃的结构简式如图,下列说法中正确的是( )
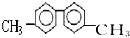

| A. | 该烃分子中最多有6个碳原子处于同一直线上 | |
| B. | 该烃分子中至少有10个碳原子处于同一平面上 | |
| C. | 该烃的一氯代物最多有四种 | |
| D. | 该烃是苯的同系物,能使酸性高锰酸钾溶液褪色 |
15.在下列变化过程中,被破坏的作用力正确的是( )
| A. | 冰融化一一共价键 | B. | 氢氧化钠熔融--离子键、共价键 | ||
| C. | 氯化氢溶于水--范德华力 | D. | 硫酸氢钠溶于水--离子键、共价键 |
12.化学用语是化学学科中最美的语言,下列有关化学用语使用不正确的是( )
| A. | 钙的元素符号:Ca | B. | 硫离子结构示意图: | ||
| C. | 二氧化碳的结构式 O=C=O | D. | NaCl的电子式: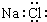 |
9.下列金属中,按照金属性从弱到强的顺序排列的是( )
| A. | 铝、镁、钠、钾 | B. | 镁、铝、钾、钠 | C. | 钙、钾、铷、钠 | D. | 钙、钾、钠、锂 |
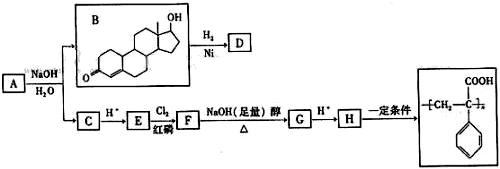
 某研究小组探究:
某研究小组探究: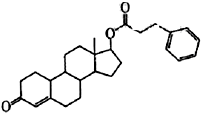
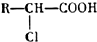 +HCl
+HCl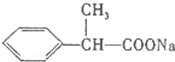
 (其中两种)
(其中两种)