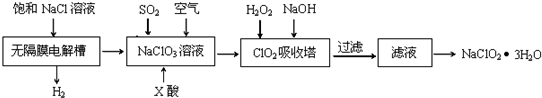
题目内容
2.邻苯二甲酸酯类是最常见的塑化剂,实验室制备邻苯二甲酸二丁酯的反应原理如下,其中n-C4H9OH表示正丁醇.
已知:(1)上述反应的第一步进行得迅速而完全,第二步反应可逆,较难进行.
(2)有关物质的性质如下表所示:
| 物质 | 性质(沸点及分解温度均为101kPa测得) |
| 邻苯二甲酸酐 (M=148g/mol) | 白色针状晶体.不溶于冷水,溶于热水及有机溶剂. 密度1.53g/cm3,沸点295℃. |
| 正丁醇(M=74g/mol) | 无色液体.微溶于水,溶于有机溶剂.密度0.81g/cm3,沸点117.7℃.可与水形成二元共沸物(沸点92.7℃). |
| 邻苯二甲酸二丁酯 (M=278g/mol) | 无色油状液体.难溶于水,溶于有机溶剂.密度1.49g/cm3,沸点340℃.酸性条件下180℃以上易发生分解. |
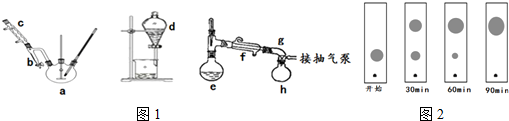
(Ⅰ)制备粗产品:在三颈烧瓶侧口插入温度计,另一侧口连接分水器与冷凝管,从中间口先加入3g(0.02mol)邻苯二甲酸酐及几粒沸石,在振摇下缓慢加入6.5mL(0.07mol)正丁醇和0.1mL浓硫酸的混合液.安装搅拌装置.在分水器中加入正丁醇至支管平齐.缓慢升温,使混合物微沸,至瓶内固体完全消失.继续回流,分水器中有小液滴沉入底部,当温度升到140℃时便可停止加热.
(Ⅱ)粗产品纯化:当反应液冷却到70℃以下时,将混合液转入分液漏斗,加入10mL 5% Na2CO3溶液洗涤,有机层用15mL温热的饱和食盐水洗涤2~3次,至有机层呈中性,分离出的油状物,用无水硫酸镁干燥,除去干燥剂.有机层先蒸去过量的正丁醇,最后在抽气泵的减压下蒸馏,收集180~190℃的馏分即得产品,称量质量.回答下列问题:
(1)仪器e的名称蒸馏烧瓶,浓硫酸的作用是催化剂,吸水剂抽气泵的作用是可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度.
(2)制备装置中冷凝水的流向与冷凝管中蒸汽的流向相同,制备过程中反应进行到终点的标志是分水器中的水位不再发生变化.
(3)产品纯化过程中,加入Na2CO3溶液的目的是将硫酸和
 转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.
转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.(4)实验中还可采用薄层色谱法(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始后的不同时间,用毛细管从三颈烧瓶中取样、点样、薄层色谱展开后在紫外灯照射下(含苯环结构的物质可显色)斑点如图2.你认为不可能出现的情况是D.
A.开始 B.30min C.60min D.90min.
分析 (1)依据装置图和仪器的用途分析回答仪器名称;浓硫酸在反应中起到催化作用,吸水剂;用减压蒸馏的目的是减压蒸馏可降低有机物的沸点;
(2)冷凝管应从下口进水,上口出水;根据分水器中的水位不再发生变化,说明反应结束;
(3)碳酸钠溶液洗涤的目的是用碳酸钠除去酯中的硫酸和 ;根据氢氧化钠碱性较强,能使邻苯二甲酸二丁酯发生水解;邻苯二甲酸二丁酯在盐溶液中溶解度会降低;
;根据氢氧化钠碱性较强,能使邻苯二甲酸二丁酯发生水解;邻苯二甲酸二丁酯在盐溶液中溶解度会降低;
(4)对照图上的斑点分析,可以知道,反应开始时图上的斑点是反应物,由此可推知,回流30min、60min时的图上,下面的斑点为反应物,上面的斑点为生成物,90min时则图上的斑点是生成物,而反应物基本上无剩余,但不会消失;
解答 解:(1)蒸馏时使用的仪器e的名称蒸馏烧瓶;浓硫酸在反应中起到催化作用,吸水剂,加快化学反应速率,促使平衡正向移动;用减压蒸馏的目的是减压蒸馏可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度;
故答案为:蒸馏烧瓶;催化剂,吸水剂;可降低有机物的沸点,可以防止有机物脱水碳化,提高产物的纯度;
(2)冷凝管应从下口进水,上口出水,则制备装置中冷凝水的流向与冷凝管中蒸汽的流向相同,根据分水器中的水位不再发生变化,说明反应结束;
故答案为:相同;分水器中的水位不再发生变化;
(3)产品纯化过程中,加入Na2CO3溶液的目的是使硫酸和 转变成盐,从而与产物分离;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;邻苯二甲酸二丁酯在盐溶液中溶解度会降低,所以加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度;
转变成盐,从而与产物分离;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;邻苯二甲酸二丁酯在盐溶液中溶解度会降低,所以加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度;
故答案为:将硫酸和 转变成盐,从而与产物分离;否;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;降低邻苯二甲酸二丁酯的溶解度;
转变成盐,从而与产物分离;否;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;降低邻苯二甲酸二丁酯的溶解度;
(4)对照图上的斑点分析,可以知道,反应开始时图上的斑点是反应物,由此可推知,回流30min、60min时的图上,下面的斑点为反应物,上面的斑点为生成物,90min时则图上的斑点是生成物,而反应物基本上无剩余,但不会消失,因此,不可能出现的情况是D;
故选:D.
点评 本题以物质的制备为背景,考查蒸馏、分液等基本操作,掌握实验操作的要求和实验原理是解题的关键,难度较大.

 优学名师名题系列答案
优学名师名题系列答案| A. | N2 | B. | NH3 | C. | NO | D. | NO2 |
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别和100mL物质的量为5mol/L的稀硝酸充分反应,所取样品质量与产生气体体积.(标准状况测定)如表所示:
| 实验编号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
(1)a实验结束后,溶液中c(NO3-)=2.75mol/L.
(2)b实验结束后,溶液的pH=0.
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:(1)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10.处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)<c(HCN)(填“>”、“<”或“=”).
(2)已知:
①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)═Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g).下表为该反应在不同温度时的平衡常数.
| 温度/ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
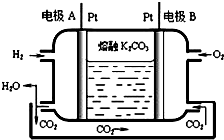
(7)一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
| A. | 钙的元素符号:Ca | B. | 硫离子结构示意图: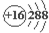 | ||
| C. | 二氧化碳的结构式 O=C=O | D. | NaCl的电子式: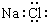 |
 某研究小组探究:
某研究小组探究: